| Top 車山高原 車山高原お知らせ 車山ブログ
|
 |
細胞で見られる主な小分子が、その生体にとって重要な役割をし、その数種の元素からなる少数の分子群が、驚くほど多様な生物の形態と振舞いを生み出している。
水を除けば細胞内のほぼ全ての分子は、炭素を基本にしている。炭素は元素の中でも、大きな分子を作る能力が著しく突出している。
ケイ素(原子番号 14)も最外殻の電子の数が同じであっても、その能力は比ぶべくもなく劣っている。炭素原子(原子番号6)は小さく最外殻に電子4個の空きがあるので、4つの共有結合が作れる。特に大事なのは、炭素原子同士が非常に安定的な「C-C共有結合」を作る事である。このため鎖状や環状の分子、更には巨大で複雑な分子が、限りなく大きくできる。
細胞が作る炭素化合物は、分子の大小を問わず有機分子(organic molecule)で、それ以外の全ての分子は、水を含めて無機分子(inorganic molecule)である。
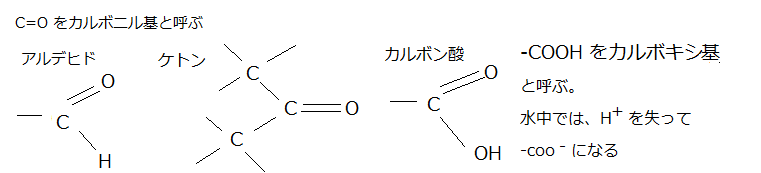
メチル基(-CH3)・ヒドロキシ基(-OH)・カルボキシ基(-COOH)・カルボニル基 ( >C=O;二重結合の基)・ホスホリル基またはリン酸基(-PO32-)・アミノ基(-NH2)などお決まりの原子の組み合わせが、有機分子に頻繁に現れる。
このような基(chemical group)には、それぞれ特有の物理的・化学的性質があり、その基を含む分子の振る舞い、例えばプロトン(H+)の授受の傾向や相互作用する分子の種類などに影響する。そのため基の種類と化学的性質を知れば、基はATP や DNA あるいは RNA の官能基(functional group;有機化合物を特性づける原子団)となって結合しているため、生体内での化学的反応が理解しやすくなる。
リン酸は、水と反応すると、3 価の酸として作用して、3個のヒドロニウムイオン(hydronium ion;H3O+)を放出する。
リン酸二水素イオン(H2PO4−)→リン酸水素イオン(HPO42−)→リン酸イオン(PO43−)
H3PO4 + H2O ⇌ H3O+ + H2PO4-
H2PO4- + H2O ⇌H3O+ + HPO42-
HPO42- + H2O ⇌ H3O+ + PO43-
水溶液では、一般的には、強塩基性条件では、リン酸イオンは PO43- の状態で存在する。弱塩基性条件ではリン酸水素イオン HPO42- として、弱酸性条件ではリン酸二水素イオン H2PO4- として存在する。
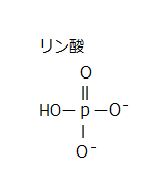 無機リン酸水素イオン(HPO42-)は、リン酸二水素イオン(H2PO4−)からできる安定したイオンである。Piと書かれることもある、生体にとって必須のイオンである。血中リン濃度は、主に腸管吸収・骨代謝(骨形成・吸収)・腎臓における排泄と再吸収により維持されている。特に、腎臓からの再吸収能は、リン恒常性維持において、中核となる重要な役割を果たしている。
無機リン酸水素イオン(HPO42-)は、リン酸二水素イオン(H2PO4−)からできる安定したイオンである。Piと書かれることもある、生体にとって必須のイオンである。血中リン濃度は、主に腸管吸収・骨代謝(骨形成・吸収)・腎臓における排泄と再吸収により維持されている。特に、腎臓からの再吸収能は、リン恒常性維持において、中核となる重要な役割を果たしている。リン酸骨格をもつ他の類似化合物群は、リン酸類(phosphoric acids)と呼ばれて、リン酸化物に水を反応させることで生成される。生化学の領域では、ATP や DNA あるいは RNA の官能基として結合しているものを指す。
リン酸水素イオン(HPO42-)は、体内のカルシウムイオン(Ca2+)とイオン結合し、リン酸水素カルシウム(CaHPO4)という塩(えん)となり、腸管から血中に吸収され、骨の主要なミネラル(骨塩)となる。人の骨の60%、歯のエナメル質の97%は、リン酸カルシウムの一種であるヒドロキシアパタイト( hydroxyapatite;Ca10(PO4)6(OH)2 )からできている。その骨や歯を丈夫にする物質が過剰となると、腎臓の機能を低下させ、不要なリンを尿中に排泄することが困難となり、血液中にリンが溜まりやすくなる。人体は、そのバランスを保つために、骨からカルシウムを取り出すようになり、結果的に骨が脆く弱くなる。またリンとカルシウムが体の血管・腱・肺などに沈着して、動脈硬化や異所性石灰化(必要のないところに石灰化が生じる)を起こすこともある。
その予防には、リンの摂取量を減らして血液中のリンの濃度を適正な値に維持することが必要になる。
C-O 化合物、その生体化合物には、炭素と酸素の共有結合を持つものが多い。
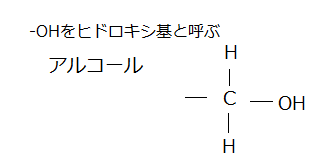 ヒドロキシ基は、水酸基ともいい、構造式は-OHと書かれる官能基で、リン酸基は、このやり方でタンパク質と結合することが多い。 リン酸と遊離のヒドロキシ基(hydroxyl=haidrɑ́ksl
group)からリン酸エステル(H3PO4)ができる。糖類のリン酸エステルは天然にも存在し、糖の代謝など生体内での重要な反応に関与している。リボ核酸(RNA)やデオキシリボ核酸(DNA)も核酸塩基と、糖の一種であるリボース(ribose)およびデオキシリボース(deoxyribose)に存在するリン酸エステルが、核酸塩基と結合してヌクレオチドを構成する。
ヒドロキシ基は、水酸基ともいい、構造式は-OHと書かれる官能基で、リン酸基は、このやり方でタンパク質と結合することが多い。 リン酸と遊離のヒドロキシ基(hydroxyl=haidrɑ́ksl
group)からリン酸エステル(H3PO4)ができる。糖類のリン酸エステルは天然にも存在し、糖の代謝など生体内での重要な反応に関与している。リボ核酸(RNA)やデオキシリボ核酸(DNA)も核酸塩基と、糖の一種であるリボース(ribose)およびデオキシリボース(deoxyribose)に存在するリン酸エステルが、核酸塩基と結合してヌクレオチドを構成する。正電荷(δ+)を帯びるプロトン(H+)は、水溶液中で水分子から水分子へと動き続ける。酢酸分子(化学式CH3COOH;分子式C2H4O2)は、水に溶けると殆どすべての分子が酢酸イオン(CH3COO-)となり、その負電荷(δ-)を帯びた酸素原子(O)にプロトン(H+)が極性共有結合をする。そのプロトンを介して水分子のO原子の部分負電荷(δ-)と結合する。その結果として酢酸イオンとヒドロニウムイオンができるが、水分子の間では、絶えずプロトンが交換され、酢酸と水の分子に戻る。
2H2O → H2O + H+ + OH- → H3O+ + OH-
CH3COO- + H+ ⇌ CH3COOH
CH3COOH + H2O ⇌ CH3COO- + H3O+
このプロトンが水分子から水分子へと移れるので、ヒドロニウムイオン(hydronium;化学式H3O+)と水酸化合物イオン(化学式OH-)ができる。
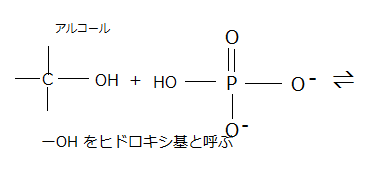
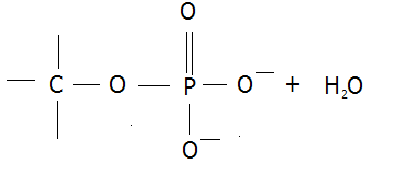
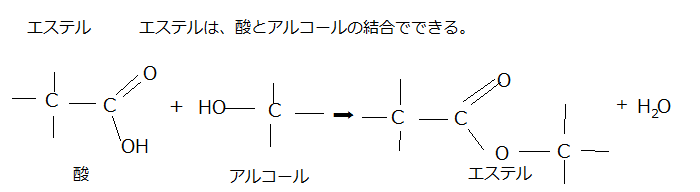
エステル(ester;éstə)は、カルボン酸とアルコールを反応させると、有機化合物の分子内、もしくは分子間で水分子を脱離する脱水反応(dehydration reaction ;dìːhɑɪdréɪʃən)を起こす。その結果イオン化し、構造式 -COO- で表されるエステル結合(ester bond)を持つ化合物が生成される。このようなエステル結合をもつ化合物をエステル(ester)という。エステルを生成する脱水反応をエステル化(esterification)という。
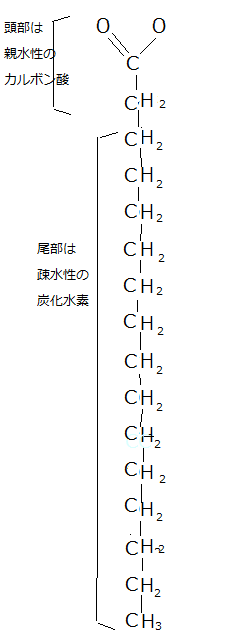
カルボキシ基(-COOH)は、水溶液中ではイオン化(-COO-)し、酸(カルボン酸)として振舞う。親水性で反応性が高く、細胞内では、殆どの脂肪酸がカルボキシ基を介して、他の分子と共有結合している。脂肪酸のように、疎水性部分と親水性部分の両方を持つ分子を「両親媒性」であるという。
脂肪酸とグリセロールのエステル結合であるパルミチン酸の構造式(化学式:C16H32O2)でみると、疎水性の炭化水素鎖が親水性のカルボキシ基(-COOH)と結合している様子が分かる。

細胞には、それぞれ炭化水素鎖の長さやC=Cの二重結合の数と位置が異なる様々な脂肪酸が存在している。どの脂肪酸も、カルボキシ基に長い炭化水素鎖の尾部が結合しているのが特徴である。
アミノ基(-NH2;amino group)は、-NH2で表わされる1価の基で、無機化合物アンモニア (ammonia) の分子式がNH3 であるから、それから水素原子1個を除いたものに相当する。
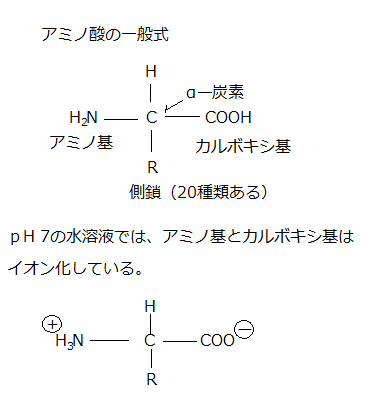
アミノ酸(amino acid)は有機小分子で、α-炭素に、カルボキシ基(-COOH)・アミノ基(-NH2)と側鎖(R)が、1個ずつ結合しているのが特徴である。アミノ酸はどれも、α-炭素に結合する側鎖を持つが、その側鎖の違いにより、種類が豊富なアミノ酸を区別できる。アラニンは最も簡単なアミノ酸であるが、その側鎖はメチル基(CH3)である。
側鎖は、大きく「酸性」「塩基性」「非荷電で極性を持つ」「極性を持つ」のいずれかに分類できる。その20種類のアミノ酸は、それぞれ3文字と、その1文字の略語で表わされる。
例えば、アラニン=Ala=Aの手順で簡略される。
 細胞は、アミノ酸を使ってタンパク質を作る。タンパク質は、アミノ酸が一定方向に結合する長い鎖状の重合体で、鎖が様々に折り畳められて、それぞれ独自の三次元構造となっている。
細胞は、アミノ酸を使ってタンパク質を作る。タンパク質は、アミノ酸が一定方向に結合する長い鎖状の重合体で、鎖が様々に折り畳められて、それぞれ独自の三次元構造となっている。隣同士のアミノ酸の共有結合をペプチド結合という。ペプチド結合は、アミノ酸同士が縮合反応(condensation)で繋がっている。アミノ酸の鎖をポリペプチド(polypeptide;polyは複数の・多種の意)という。
縮合(condensation)とは、2個以上の分子を、原子または水・アンモニア・アルコールなどの原子団を解離して作られる新たな共有結合を言う。
CH3COOH(酢酸)+C2H5OH(エタノール) → CH3COOC2H5(酢酸エチル)+H2O
縮合する2個の分子が、それぞれ水素原子(H)と水酸基(-OH)を解離する脱水縮合反応(dehydration; dìːhɑɪdréɪʃən脱水;condensation reaction)により、カルボン酸とアルコールから、エステル(構造式 ―COO―で表記される)と水分子が作られるのもその一例である。
タンパク質や糖および核酸などの生体高分子も、ある分子の-OH基と別の分子の-OH基とが結合する際に起きる、水分子1個の解離による縮合反応が連続して作られる。 縮合反応による結合を、元に戻す加水分解(hydrolysis)は、水分子を1個加えることにより、その結合を切っていく。
ポリペプチド鎖に組み込まれると、アミノ基とカルボキシル基の電荷はなくなる。どんなポリペプチド鎖の両端にも、一方の端にはアミノ基(H2N)を持つためN末端と呼ばれもの、その反対には、カルボキシル基(COOH)を持つためC末端と呼ばれる末端部がある。この両端の違いによりポリペプチド鎖に方向性が生じ、構造上の極性、つまり化学的差や性質・機能の違いとなってあらわれる。
タンパク質内のアミノ酸配列は、常にN末端を左の置いて書き、N末端から読む。アミノ酸が結合する個々のペプチドは短いが、タンパク質は、通常アミノ酸50個以下の長い重合体である。
α-炭素(α位の炭素原子)とは、有機化合物中の炭素原子が占める位置を表す。官能基の隣に位置する主鎖側の炭素原子がそれである。アラニン=Ala=Aのアミノ酸では、カルボキシル基に結合するα-炭素が、アミノ基とも結合している。
アミノ酸は、細胞内ではpHが7に近いため、遊離のアミノ酸はイオン化して存在する。しかしポリペプチド鎖(アミノ酸の長い鎖)に組み込まれると、カルボキシ基(-COOH)・アミノ基(-NH2)の電荷は失われる。