| Top 車山高原 車山高原お知らせ 車山ブログ
|
|
 |
DNA DNAが遺伝物質 生物進化と光合成 葉緑素とATP 植物の葉の機能 植物の色素 葉緑体と光合成 花粉の形成と受精
ブドウ糖とデンプン 植物の運動力 光合成と光阻害 チラコイド反応 植物のエネルギー生産 ストロマ反応
植物の窒素化合物 屈性と傾性(偏差成長) タンパク質 遺伝子が作るタンパク質 遺伝子の発現(1) 遺伝子の発現(2)
遺伝子発現の仕組み リボソーム コルチゾール 生物個体の発生 染色体と遺伝 対立遺伝子と点変異 疾患とSNP 癌変異の集積
癌細胞の転移 大腸癌 細胞の生命化学 酸と塩基 細胞内の炭素化合物 細胞の中の単量体 糖(sugar) 糖の機能 脂肪酸 生物エネルギー
| 目次 |
| 1)光合成生物が有機分子を合成する |
| 2)細胞は有機分子を酸化してエネルギー源とする |
| 3)原子の結合 |
| 4)酸化と還元で電子が移動する |
食物分子は、動物が生体物質を作るのに必要な原子の供給源となる。動物は、必要なすべての有機分子を食物として摂取し、その化学結合により蓄えられたエンルギーを生命の支えとして生きている。食物源であれば、動物自体も含まれるが、その食物分子は、本来、植物を供給源とする。生体が外界から摂取する地球上の酸素も、植物に由来する。植物があっての動物の登場であった。
一方植物は、日光から直接エネルギーを獲得している。動物が植物や植物を食べる動物を食べて得られるエネルギーも、すべて太陽に由来していることになる。
太陽エネルギーは、日光の電磁エネルギーを細胞内の化学結合エネルギーに変換する光合成(photosynthesis)によって生物界に入る。植物・藻類や一部の細胞などの光合成生物は、日光から得たエネルギーを用いて、糖・アミノ酸・ヌクレオチド・脂肪酸の単位体となる小分子を合成する。それら小分子から、多糖・タンパク質・核酸・脂質など、植物体を形成する巨大分子を生合成する。
光合成には2段階があり、第一段階では、日光エネルギーが、特定の小分子に捕らえられ、植物では、活性運搬体という特殊な分子「アンテナ複合体LHG」に化学結合エネルギーとして一時的に蓄えられる。動物が呼吸する空気中の酸素は、この光合成の第一段階で、主に地中の水分子が使われて分解され放出される。
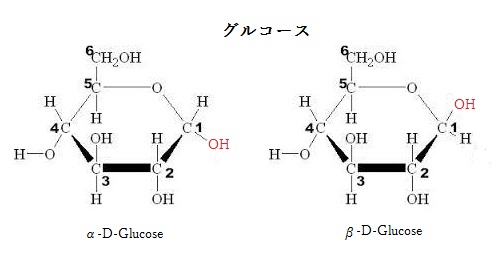
第2段階では、活性運搬体が、空気中の二酸化炭素から糖を作る炭素固定を進行させる。単糖には多くの誘導体がある。誘導体とは、基本的に化学構造の一部を変化させたもので、特に単糖の誘導体は誘導糖と呼ばれる。グルコースなどの単糖の誘導体では、ヒドロキシ基が、他の基で置き換えられる。カルボキシル基(-COOH)に置き換わりグルクロン酸、アミノ基(-NH2)に置き換えられるグルコサミン、水素原子をアセチル基(-CH3CO)で置き換えるN- アセチルグルコサミンなどになる。
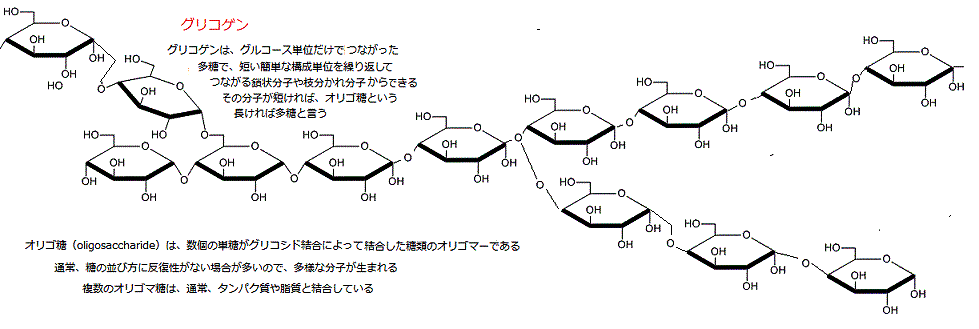
小さなオリゴは、タンパク質と共有結合して糖タンパクになり、脂質と共有結合すれば糖脂質となる。いずれも細胞膜にあり、それらに結合する糖鎖は、細胞表面を保護し、細胞同士を接着させているようだ。細胞表面の糖鎖の種類の違いにより、ヒトの血液型の分類を決定する分子的基盤となっている。
この2段階に及ぶ光合成により、植物はもとより、それを食べる動物にも必須な化学結合エネルギーとなり、やがて炭素化合物を単位体とする巨大な重合体となるタンパク質などの有機物質を構成していく。
(オリゴマーとは、単量体(モノマー)が低い程度に重合してできた重合体で、分子量が1万以下の低重合体をいうが、その範囲は明確ではない。オリゴマーは低分子と高分子の中間的な性質を持つ。 )
目次へ
動物細胞も植物細胞も、有機分子の化学結合に蓄えられた化学エネルギーに頼る。有機分子とは、植物が光合成の第2段階で自家消費用として作った糖や、動物が食餌により獲得する大小の分子の化合物である。生物は、このエネルギーを活用するため、緩やかな酸化、則ち制御された燃焼を行う。
地球の大気には、酸素が21%含まれている。それを生み出した植物の功績により、その酸素は、エネルギー的に最も安定した形が、炭素と結合するCO2であり、水素と結合するH2Oである。細胞は、糖などの有機分子の炭素原子と水素原子を酸素と結合させている。これが酸化である。それぞれCO2 とH2Oに変えてエネルギーを獲得する。この過程が呼吸(respiration)である。
光合成と細胞の呼吸は、相補的な過程である。これは植物と動物の関係が一方的でないことを意味する。植物・動物・微生物は、地球上で長く共存してきたため、それぞれが互いの環境の一部として不可欠な存在になっている。光合成によって放出される酸素は、殆どの生物が行う有機分子の酸化分解の際に消費される。草木の葉が、光合成によって有機分子として取り込むCO2分子の一部は、動物や菌類、あるいは植物自体の呼吸によって、さらには化石燃料の燃焼によって、大気中に放出されたものである。このような酸素の利用は、生物間の境界を越えて、生物圏全体を巻き込む巨大な循環を形成している。
光合成と細胞呼吸は、生物界において相補的な関係にある。日光エネルギーを利用して大気中のCO2の炭素原子から、糖とそれから生成される巨大な脂肪やタンパク質などの有機分子が作られる。これらは他の生物の食物となる。光合成微生物を含む殆どの生物が行う細胞呼吸では、O2を用いて食物分子を酸化し、その炭素原子をCO2として大気中に放出する。この過程で生物は、生存に必要な使いやすい化学総合エネルギーを獲得する。
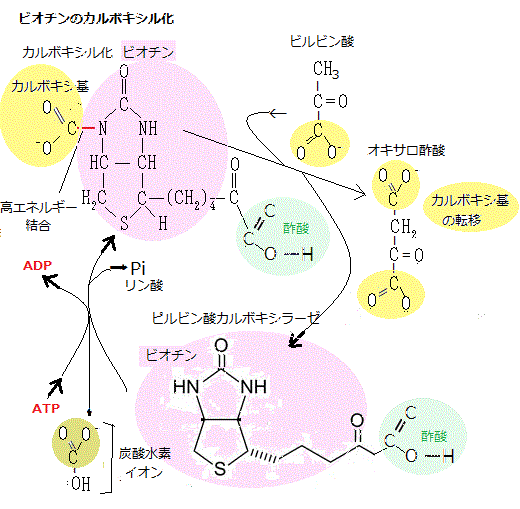 植物が獲得する化学総合エネルギー、例えばATPは、細胞内のミトコンドリア・マトリックスにあるクエン酸回路で、全体として8個の反応を通過する回路が1周するたびに、末端のリン酸基をADPに渡しATPを作る。
植物が獲得する化学総合エネルギー、例えばATPは、細胞内のミトコンドリア・マトリックスにあるクエン酸回路で、全体として8個の反応を通過する回路が1周するたびに、末端のリン酸基をADPに渡しATPを作る。FADH2はNADHと同様、高エネルギー電子と水素の運搬体である。NADHやFADH2の転移しやすい高エネルギー電子に蓄えられたエネルギーは、酸化的リン酸化によりATP合成に使われる。
酸化的リン酸化はミトコンドリア内膜で起こり、真核細胞における食物の酸化的異化のうちで大気中のO2を直接必要とする唯一の過程である。
生物体がエネルギーおよび物質を外部から取り込み(同化)、体内で化学的に変化させる。不用なものは外部に放出する。
食物の主要成分であるタンパク質・脂肪・多糖を、真核細胞がエネルギー源や他の有機分子の単位体として利用するためには、これらを小分子に分解しなければならない。酵素が複雑な有機分子を、簡単な有機分子に分解する過程を異化(catabolism)と言う。
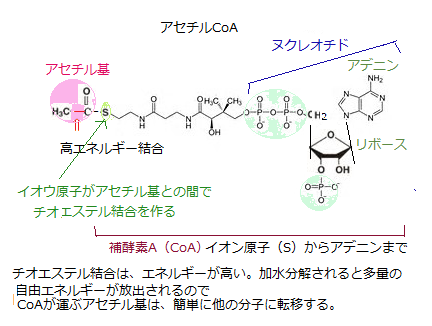
異化の最終段階は、ミトコンドリア・マトリックで起こる。アセチルCoAのアセチル基がオキサロ酢酸分子に転移してクエン酸ができる。ここからクエン酸回路という一連の反応に入る。
転移したアセチル基は、この反応でCO2に酸化され、その際に大量のNADHが生じる。最後に、NADHの高エネルギー電子が、ミトコンドリア内膜にある酵素群である電子伝達系をたどる。
ここで電子の移動に伴って放出されるエネルギーが、酸化的リン酸化、即ちATPの生成とO2ガスの消費を行う。
この酸化によって放出されたエネルギーで、細胞の殆どのATPが作られる。この最終段階で、糖や脂肪の分解で取り出されたエネルギーが、細胞内で使われやすいATPというエネルギーの塊に変換される。
全体としてグルコースや脂肪酸のH2OとCO2への分解で、理論的に得られるエネルギーの約半分が捕捉され、 エネルギー的に起こりにくい ADP + P1 ➡ ATP の反応を進めるのに使われる。
 クエン酸回路については、反応を進めるのに必要な大気中のO2が、廃棄物として放出されるCO2と結合していると誤解されがちだが、実際は、クエン酸回路に入ったアセチル基をCO2にするのに必要な酸素原子は、大気中のO2ではなく地中のH2Oから供給される。
クエン酸回路については、反応を進めるのに必要な大気中のO2が、廃棄物として放出されるCO2と結合していると誤解されがちだが、実際は、クエン酸回路に入ったアセチル基をCO2にするのに必要な酸素原子は、大気中のO2ではなく地中のH2Oから供給される。 地球上に最初に誕生した細胞は、光合成や細胞呼吸が不可能な環境に置かれた。呼吸ができるくらいに十分なO2が大気を満たすまでは、植物による何十億年にわたる光合成が前提になければならない。
光合成で放出されたO2を活用して、初めて、植物のミトコンドリア・マトリックス内のクエン酸回路で8個の反応を行うことができる。
動物・植物・藻類・細菌が腐植・分解した堆積物が、化石燃料として人により燃やされCO2の形で大気中に戻されていく。
目次へ
細胞内での有機分子の酸化は、燃焼とは異なる代謝である。さりとて分子に直接酸素を付加する反応は稀で、酵素を用いて何段階かの反応を進めていく。
酸化(oxidation)とは、酸素原子の付加だけを意味するものではない。電子がある原子から別の原子へ移動する化学反応で、酸化とは、電子が原子から取り去られることを言い、酸化とは逆反応である還元(reduction)は、電子が原子に付加される現象を言う。イオン化傾向が高い原子番号 26の鉄は、酸化すると酸化鉄になる。その酸化鉄Fe2+が電子を1個失いFe3+になれば、Fe2+は酸化されたと言う。Fe2+のものを酸化させるとFe3+に、Fe3+のものを還元するとFe2+になる。
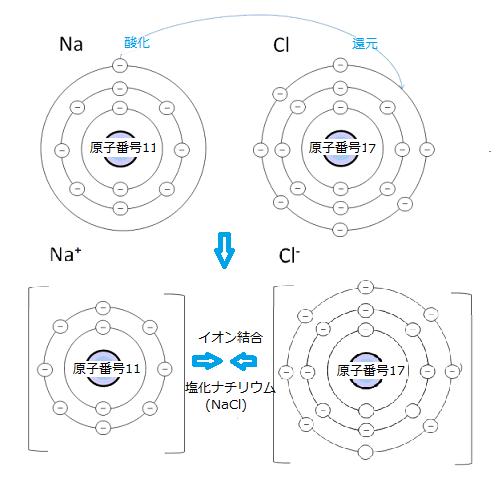 塩素原子(Cl)の最外電子殻の電子は7個である。あと1個の電子があれば満たされる。ナトリウム原子(Na;原子番号11)の最外電子殻にあたる第3電子殻には、電子は1個だけである。その電子を放出すれば最外殻が満たされる。Na原子が、 Cl原子に出合うと最外殻にある1個の電子が、Cl原子に飛び移り、どちらの原子の最外殻も満たされるようになる。これにより、激しく反応する柔らかい金属のナトリウムが、緑色の有毒気体の塩素とイオン結合して、食塩(NaCl)ができる。この場合、ナトリウム原子は酸化され、それにより塩素原子は還元されたという。
塩素原子(Cl)の最外電子殻の電子は7個である。あと1個の電子があれば満たされる。ナトリウム原子(Na;原子番号11)の最外電子殻にあたる第3電子殻には、電子は1個だけである。その電子を放出すれば最外殻が満たされる。Na原子が、 Cl原子に出合うと最外殻にある1個の電子が、Cl原子に飛び移り、どちらの原子の最外殻も満たされるようになる。これにより、激しく反応する柔らかい金属のナトリウムが、緑色の有毒気体の塩素とイオン結合して、食塩(NaCl)ができる。この場合、ナトリウム原子は酸化され、それにより塩素原子は還元されたという。イオン結合(ionic bond)は、電子を共有結合するよりも、他の原子に電子を移すか、電子を受け取る方が、最外殻を満たしやすい原子間で形成される。Na原子がCl原子と出合うと、電子が1個Na原子からCl原子に飛び移り、双方の最外殻が満たされる。
ナトリウムは、非常に反応性の高い軟らかい金属で、日本の工業分野では、特に化合物中のナトリウム成分を曹達(ソーダ)と呼び、「毒物及び劇物取締法」により劇物に指定されている。それが緑色の有毒気体である塩素とイオン結合して、美しい無色透明な結晶となり塩化ナトリウム(NaCl)という化合物・塩ができる。それが、地球上の大半の生物にとって、生命維持に欠かせない重要な物質となる。
Na原子からCl原子に電子が飛び移ると、互いの原子は電荷を帯びた2個のイオン(ion; άɪən)が生じる。
マイナスの電子を1個失ったNa原子は、正電荷を持つ陽子より負電荷の電子が一個減るため、原子は1価の正電荷を持つ(Na+)。電子を1個余分に獲得したCl原子は、陽子より電子が1個多くなり、1価の負電荷を持つ(Cl-)。Na+とCl-は、反対の電荷を持つため静電引力で互いに引き合うようになる。
 化学反応全体としては、力学的エネルギー保存の法則と同様、電子の数に増減はない。イオン結合して食塩となるように、酸化と還元は同時に起こる。
化学反応全体としては、力学的エネルギー保存の法則と同様、電子の数に増減はない。イオン結合して食塩となるように、酸化と還元は同時に起こる。糖分子が酸化されてCO2(O = C = O)とH2Oになるとき、H2O を作るO2分子は電子(H+)を獲得して還元されている。CO2では、Oの最外核電子が6であるため、隣の原子から1つ電子を提供されても、電子は7個で1個不足となる。Cの最外核電子は4であるから、左右の2個のC原子から、2個ずつ電子を共有結合すれば、最外殻を8個で満たせる。
大きな原子では例外もあるが、電子はより内側の電子殻から満たされていく。電子で完全に満たされていない原子の最外殻は、満たされている原子と比べると、電子殻を満たそうと他の原子と電子を融通しようとして不安定になる。しかし、最も外側の電子殻(最外殻)が電子で満たされている原子は、特に安定し化学反応性に乏しい。
水素原子は電子を1個しか持たず、最外殻が半分しか満たされていないため、非常に反応性が高い。
生物体では、水素・炭素・酸素・窒素など、最外殻が満たされていない原子同士が反応して分子を構成していく。
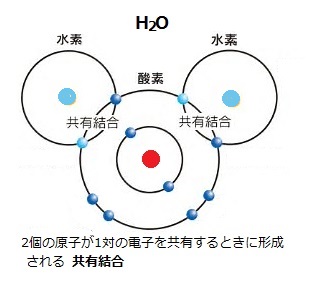
 原子が、他の原子との間で、電子を融通し合って電子殻を満たそうとする。そのため電子が別の原子に移動する2通りの方法がとられる。
原子が、他の原子との間で、電子を融通し合って電子殻を満たそうとする。そのため電子が別の原子に移動する2通りの方法がとられる。Na原子が、 Cl原子に出合うと、Na原子の電子の1個がCl原子に飛び移り、双方の最外殻が満たされるのがイオン結合であり、2個のH原子がO原子に共有結合したのが水分子H2O である。
O2分子は電子(H+)を獲得して還元されている。H2Oの正電荷領域(H+)が、別のH2O分子の負電荷領域(O-)に近づくと、両者間では電気的な引力が働く。これが水素結合(hydrogen bond)と呼ばれる弱い結合である。
水の構造は、水素結合によって一時的に格子を作る。これにより水は凝集しやすくなり、表面張力・比熱(1gあたりの物質の温度を1度上げるのに必要な熱量)・気化熱など、いずれも高いといった特異性を持つようになる。
共有結合の多くは、2個の原子から1個ずつ提供され電子2個を共有する単結合であるが、CO2のように複数対の電子を共有する二重結合では、O原子2個から2ずつ電子が提供されるので、4つ電子が不足するCの最外核が8となり満たされる。
二重結合は、単結合よりも短く強く、単結合であれば結ばれた2個の原子は、通常、結合軸の周りを互いに自由に回転できるが、二重結合では、自由な回転ができないため、原子の配置に自由度がない。その一方では、分子の三次元構造を決めるうえで特異な役割を担う。ベンゼンのように環状分子に交互に並んだ二重結合があれば、分子構造は非常に安定する。
炭素と水素からなる炭化水素という安定した化合物、または基ができる。C原子とH原子は、両方の原子がほぼ同じ力で電子を引き付けるから、炭化水素のC-H間は非極性である。また水素結合を作らず、しかも水に溶けないのが普通である。
目次へ
炭素原子(原子量12)が、電子親和性の高い酸素(原子量16)や塩素(原子量35)・硫黄(原子量32)などの原子と共有結合すると、電子を均等に共有できなくなり、極性共有結合ができる。この場合、炭素の原子核の正電荷が、電子が離れた分、電子の負電荷の総量を僅かに上回り、炭素原子の領域内に部分正電荷(δ+)を持つようになる。これも酸化と呼ばれる。反対にC-H結合の炭素原子は、多少なりとも電子を引き付けるため、共有電子を多く持つようになり、部分負電荷(δ-)を帯びる。これが還元されたことになる。
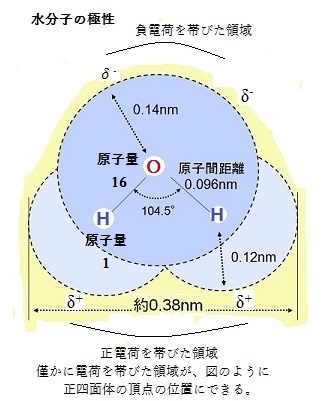
単結合する2個の原子が、異なる元素の間であれば、その共有電子を引き付ける強さも異なる。このように共有電子が偏っている共有結合を極性共有結合という。一端に正電荷(陽子)、もう一端に負電荷(陰:電子)が集中している構造を極性(polarity)と呼ぶ。分子内に存在する電気的な意味での偏りが極性である。酸素原子や窒素原子は、電子を強く引き付けるのに対して、H原子は電子を引き付ける力が弱い。これはC(原子量12)・O(原子量16)・N(原子量14)・H(原子量1)の原子核が持つ正電荷の違いによる。それでOとHの共有結合O-Hや、NとHの共有結合N-Hが極性を持つようになる。
一方、C原子とH原子は、両方の原子がほぼ同じ力で引き付けるため、C-Hの共有結合は、極性が低くなる。 極性を持った物質の例として水(H2O)が挙げられる。水分子の結合では、酸素(O)の原子核の方が、原子量で水素(H)の原子核より大きいため、共有した2個の水素の電子を引き付ける。その結果、酸素は負の電気的な偏りが生じ、逆に水素では、原子核内の陽子の正電荷に偏るようになる。電子をより引きつけている方(O)は「マイナスの電荷(δ-)(部分負電荷partial negative charge)」を、電子を引きつける力が弱い方(H)は「プラスの電荷(δ+)(部分正電荷partial positive charge)」を帯びているという。
上記のように、共有結合する2個の原子核の間で、結合電子を引き付ける強さに差がある場合、極性が生じる。結合の一方の端に僅かな負電荷(δ-)を帯びると、もう一端も僅かな正電荷(δ+)を帯びる。水分子全体では、正電荷の陽子と負電荷の電子が同数であるため、電気的に中性であるが、電子が非対称に分布するため極性が生じる。原子量が大きい酸素原子が 、水素原子から電子を引っ張るため、水素原子は、部分的に僅かな正電荷を帯びる。酸素原子の方も、電子の密度が増すため、部分的に僅かな負電荷を帯びる。
植物細胞や動物細胞は、有機分子の化学結合で蓄えられた化学エネルギーを必要とする。その有機分子とは、植物が光合成により自分用に消費するために作った糖や、動物が食べた大小の分子の混合物である。生物は、そこに蓄えられたエネルギーを使って成長し、種の存続を図るため、そのエネルギーを利用可能な形で取り出すため、植物や動物は、緩やかな酸化(oxidation)、即ち「制御された燃焼」を行う。
地球の大気には、21%の酸素が含まれている。その酸素がある限り、エネルギーとして最も安定した形が、炭素ではCO2であり、水素ではH2Oである。それで細胞は、糖などの有機分子の炭素原子と水素原子を酸素と結合させる、言わば酸化させて、それぞれCO2とH2Oに変えてエネルギーを獲得する。この過程が呼吸(respiration)である。
細胞内での有機分子の酸化は、1段階の反応では収まらない。代謝が燃焼と異なる特性は、分子に直接酸素を結合させる反応は稀で、酵素を用いて有機分子の酸化を少しずつ進める一連の反応を通してエネルギーを利用しやすい形に変えることである。
酸化は、酸素原子の付加だけを意味するものではない。一般的には電子がある原子から別の原子へ移動する反応を表す。酸化は原子から電子が取り去られることを言い、酸化に伴う逆反応が還元(reduction)で、その電子が別の原子に付加されることを言う。細胞内の分子が、電子(e−)を還元する際に、同時に水素イオン(H+)を取り込むことが多い。H+は、水中にあって、自由に利用できる。両者を合わせて、分子に水素原子が付加される。
A + e− + H+ ➡ AH
上記の水素化反応も、還元反応であり、逆向きの脱水素反応が酸化反応となる。有機分子の酸化では、C-H結合の数が減る場合で、増えれば還元である。
紙は簡単に燃え、水とCO2の気体となり、同時にエネルギーを熱として大気中に放出する。これらの反応は一方向のみで、逆反応を使って戻すことはできない。エネルギーの生成消滅は、宇宙レベルではありえないが、紙の原子や分子は灰と煙などに変わり、その構造を失い、分子のランダムな熱運動で拡散し回収は不可能となる。このように、仕事をしたり、化学反応を進めたりするのに利用できるエネルギーが失われたときに、熱力学では、「自由エネルギー」が放出されたと言う。その基本原理は、化学反応は「自由エネルギー」の減少の方向だけに進み、反応が自発的に進むのは、「下り坂」方向、即ち「エネルギー的に起こりやすい」方向だけと言える。
通常の条件で、炭素がエネルギー的に取り出しやすい形態は、CO2であり、水素ではH2Oである。その一方で、生物が作る分子は比較的安定した状態にあり、そのためエネルギーを新たに加えなければ、より低いエネルギー状態には戻れない。つまり、分子が化学反応によって低エネルギーの安定した状態に移るためには、そのエネルギー障壁を越えるための活性化エネルギー(activation energy)を、周辺から求めなければならない。細胞内では酵素(enzyme)と呼ばれるたんぱく質が、自ら触媒する特定の活性化エネルギーの障壁を大きく下げ、効率の高い触媒をする。
酵素は、基質(substrate)と呼ばれる1個か2個の分子と固く結合し、基質間の化学相互作用を進めるために必要な活性化エネルギーのレベルを大きく下げて、それを保持する。活性化エネルギーを下げる能力のある物質を触媒(catalyst)と呼ぶ。活性化エネルギーが低下すると、反応が起こりやすくなるばかりか、触媒により、基質と周囲の分子とのランダムな衝突のうち、エネルギー障壁を乗り越えるものの割合が著しく増え、その化学反応の速度も、酵素がない場合と比較して1014(100兆倍)に上がることもある。
基質分子が化学反応を起こすには、その反応の活性化エネルギーの障壁を越えるエネルギーが当然必要で、生体反応では、その条件を満たすには酵素の触媒が不可欠である。それでも、反応するのに十分な高いエネルギー状態に達する基質分子は、ごく少数である。それでも、基質分子が様々な大きさのエネルギーを持つため、周囲の分子との衝突で、飛び跳ね、振動し、回転をしながら、その波に押されるようにして、低くなった活性化エネルギーの障壁を越えて反応を引き起こす。
酵素の働きにより、通常、その細胞内温度では起こらない化学反応が可能となる。酵素の選択性は高く、個々の酵素が関わる基質が行ういくつの反応のうち、通常、特定の反応の1つしか加速しない。こうして、酵素は細胞内の種々の分子が、それぞれ特定の反応径路に入っていけるよう方向付けをし、細胞に必要な化合物だけを作る。酵素には、活性部位があり、そこに1つないし2つの基質が結合して、酵素―生成物複合体を作る。その後、生成物が酵素から離れるため、次の基質分子と結合して反応を繰り返すことができる。酵素はまた、他の触媒と同様、反応に参加し基質を生成物に変えるが、自身には変化が生じないため、何回でも働ける。
生化学反応では、ある分子から取り出された電子は、必ず別の分子に渡されるので、1つの分子が酸化されれば、常に別の分子が還元される。この酸化還元反応(redox reaction)の起こりやすさは、一般の化学反応と同じく、電子伝達に伴う自由エネルギー変化(⊿G)に依存している。しかも、反応にかかわる2種類の分子の電子に対する相対的な親和性によって決まる。
電子伝達は、生体に必要なエネルギーの大半を供給する。プロトン(proton;陽子)は、原子核中にある正電荷を持つ粒子であるため、水素イオン(H+)を呼ぶ場合もある。プロトンを供与する分子は酸と、プロトンを受け取る分子は塩基と呼ばれる。これらの分子は、共役した酸―塩基対として存在し、酸は速やかにプロントを失って塩基に変わる。
例えば、酢酸(CH3COOH)は、以下の反応で共役する塩基(CH3COO-)に変換される。
CH3COOH ⇔ CH3COO- + H+
これと同じように、NADHとNAD+のような組み合わせは、NADHが電子を失えばNAD+に変わるので、酸化還元物質対(redox pair)と呼ばれている。
NADH ⇔ NAD+ + H+ + 2e-
NADHは、強力な電子供与体であり、NADHの電子は、高エネルギー結合をしている。そのためNADHの電子が、他の分子に渡される際、⊿Gが反応を起こす方に有利に働く。NADHでは、高エネルギー結合を形成しにくいので、NADHと対をなすNAD+は必然的に弱い電子の受容体になる。
NADH / NAD+のような酸化還元物質対が電子を渡しやすいか、受け取りやすいかという傾向は、その酸化還元電位(redox potential)の測定によって決められる。
細胞が食物からエネルギーを効率よく使いやすい形で取り出す酸化径路には、多数の中間体があるが、いずれもその直前の反応物質に関して見れば、殆ど違いはない。そのため、食物分子に閉じ込められている大量のエネルギーが少しずつ分けられ、NADHやFADH2などの活性運搬体が効率よく使えるようになる。細胞内で制御された段階的な糖の酸化では、非生物系における普通の燃焼では、運搬体分子に蓄えられる以上のエネルギーが熱として放出されるのと異なり、有用なエネルギーが効率良く獲得されている。
細胞内では、酵素が糖の分解を小さな反応の連鎖となるよう触媒して、放出される自由エネルギーの一部を、主にATPやNADHのような活性運搬体が獲得していく。その各段階を触媒する酵素は、細胞の体温を条件とし、分子間のランダムな衝突を、活性エネルギーの障壁を下げることにより反応をコントロールする。グルコースの酸化的分解で分解される自由エネルギーの総量は、非生物系における普通の燃焼と全く等しく、686kcal/molである。
細胞を構成する分子は、振動・回転・運動のエネルギーと、原子間の結合で蓄えられたエネルギーを持っている。それが、細胞内程度の定温下で仕事に使える、分子が持つエネルギーである。自由エネルギーGの単位は、kcal/molまたはkJ/molで1kcal=4.184 kJである。エネルギー的に起こりやすい反応でも、開始するためには活性化エネルギーを必要とする。例えば、化合物としての反応物が比較的安定した状態にあれば、その生成物(化合物)の方が、エネルギーレベルが低くあっても、反応物を生成物に変換するには、エネルギーが必要となる。そのため反応物は、周囲から活性化エネルギーが得られなければ、生成物への変換は生じない。このエネルギーは、他の分子との間の特別にエネルギーの高い衝突によって受け取られる。その逆反応では、その活性化エネルギーがはるかに大きいため、一段と起こりにくくなる。
活性化エネルギーは、いつも正の値であるが、エネルギー的に比較的起こりやすい反応物から生成物へのエネルギー変化は、生成物全体のエネルギーから、開始時の反応物全体のエンルギーを引いたものであるため、負の値となる。これが自由エネルギーの減少に相当する。
目次へ