| Top 車山高原 車山高原お知らせ 車山ブログ
|
 |
DNA DNAが遺伝物質 生物進化と光合成 葉緑素とATP 植物の葉の機能 植物の色素 葉緑体と光合成 花粉の形成と受精 ブドウ糖とデンプン 植物の運動力 光合成と光阻害 チラコイド反応 植物のエネルギー生産 ストロマ反応 植物の窒素化合物 屈性と傾性(偏差成長) タンパク質 遺伝子が作るタンパク質 遺伝子の発現(1) 遺伝子の発現(2) 遺伝子発現の仕組み リボソーム コルチゾール 生物個体の発生 染色体と遺伝 対立遺伝子と点変異 疾患とSNP 癌変異の集積 癌細胞の転移 大腸癌 細胞の生命化学 酸と塩基 細胞内の炭素化合物 細胞の中の単量体 糖(sugar) 糖の機能 脂肪酸 生物エネルギー 細胞内の巨大分子 |
|||||
|
ゲル(ドイツ語: Gel)は、液体的な柔軟性を保ちながら、高い粘性を持ち流動性を失い、全体としては固体状になったもの。 細胞質ゾルは、分子や細胞小器官が乱雑に混ざった溶液ではない。真核細胞では、細胞質ゾルに細い線維が縦横に走っている。その線維は、細胞膜に付着していたり、核の直ぐそばの細胞中心から放射線に伸びたりしている。このタンパク質線維を細胞骨格(cytoskeleton)と呼ぶ。どの真核細胞にも豊富にあり、特に筋細胞に多く、筋肉収縮装置の主要部品となっている。細胞の機械的強度を保ち、形を整えるだけでなく、内部の活動を制御し、その動きや向きを決めている。
|
重量比で見れば、細胞内の有機分子の中で圧倒的に多いのが巨大分子であり、しかも多量にある。細菌細胞の組成は、70%がH2Oで、30%が化学物質である。30%の化学物質には4%の無機イオン小分子と2%のリン脂質があり、それ以外の24%を巨大分子(macromolecule)が占めている。
その24%の内訳は、細菌細胞全体の組成比でタンパク質15%、RNAが6%、多糖が2%、DNAが1%を占める。 タンパク質を主体とする巨大分子が細胞の構造を作り、その基本部材であるばかりか、個々の生物に特有の性質を与える存在にもなっている。巨大分子であれば、有機小分子と細胞小器官の中間の大きさであり、しかも複雑な役割を担っている。小分子である有機単量体(monomer)が共有結合で長い鎖状に繋がる重合体(polymer)は、その単純な構成成分からは想像すらできないほどの多くの性質を示す。タンパク質・多糖・核酸も単量体で繋がった重合体である。
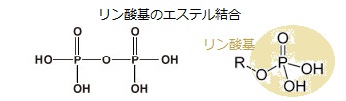 タンパク質は、極めて多様であり、細胞内で多くの違った働きをするが、その殆どは細胞内の反応を触媒する酵素である。例えば、植物ではリブロースビスリン酸カルボキシラーゼがCO2を糖に変える。化合物のビスリン酸(bisphosphate)は、リン酸基が2つ、異なる原子に結合していることを表す。これに対して「ニリン酸」は、リン酸基が2つ直列していることを表す。異なる原子に結合している3つのリン酸基を持つ化合物は、「トリスリン酸」という。
タンパク質は、極めて多様であり、細胞内で多くの違った働きをするが、その殆どは細胞内の反応を触媒する酵素である。例えば、植物ではリブロースビスリン酸カルボキシラーゼがCO2を糖に変える。化合物のビスリン酸(bisphosphate)は、リン酸基が2つ、異なる原子に結合していることを表す。これに対して「ニリン酸」は、リン酸基が2つ直列していることを表す。異なる原子に結合している3つのリン酸基を持つ化合物は、「トリスリン酸」という。これらの酵素が、植物以外の生物界で使われる有機物質の大半を作り出す。 生体内でのタンパク質の性質は、他の分子との物理的な相互作用によって決まる。
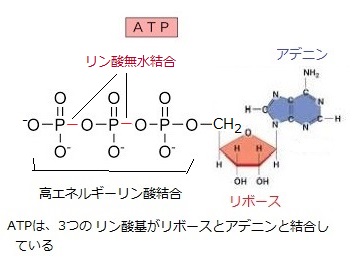 抗体はウイルスや細胞と結合して生体防御の一部となる。ヘキソキナーゼは、ATPとグルコースと結合して二者間の反応を触媒する。
抗体はウイルスや細胞と結合して生体防御の一部となる。ヘキソキナーゼは、ATPとグルコースと結合して二者間の反応を触媒する。グルコースは、リン酸化され糖リン酸となる。リン酸基の負電荷のため細胞膜を通過できず、グルコース6-リン酸は細胞内に留まる。
アクチン(actin)分子は相互に結合して細い線維のアクチンフィラメント(actin filament)を形成する。この糸状になったタンパク質の複合体は、どの真核細胞にも豊富にあり、とりわけ筋細胞に多い。 タンパク質は、いずれも、他の分子と特定のやり方で結合するのが特徴で、結合は極めて強力である場合もあれば、弱くて直ぐ消える場合もある。ただどの場合も、その結合は、極めて高い特異性がある。
特定のタンパク質が出合う数千もの分子のうち、結合できるのは1個ないし数個に過ぎない。タンパク質が結合する物質は、イオン・有機小分子・巨大分子を問わず、そのタンパク質のリガンド(ligand)と呼ぶ。Ligandは、ラテン語で結合を意味するligareを語源とする。
タンパク質が、選択的にしかも親和性(ある物質が他の物質と容易に結合する性質や傾向)でリガンドと結合するのは、水素結合・静電引力・ファンデルワールス引力など一連の弱い非共有結合に加えて、疎水力が働くからである。疎水性の尾部を構成する分子や疎水基をもつ分子などは、細胞内の水溶液中にあると、水との接触を避けるために水と接する面積を減らそうと、互いに会合する疎水力が働く。C-H結合を数多く持つ炭化水素は、非極性結合であるため疎水性である。そのため水分子を引き付けず、溶液中に出ていくことはない。
第3の共有結合と言われるファンデルワールス引力は、2個の原子が結合した場合に必ず起こる、電荷の揺らぎによって生じる弱い結合性相互作用による電気的引力である。
ファンデルワールス引力は、水素結合よりも弱いが、2個の原子が引き合えば、両原子のファンデルワールス半径の和に等しくなるまで結合するため、多数の原子が集まり、表面形状がぴったり合う巨大分子同士の結合が可能となる。そのため重要な機能を持つようになる。
タンパク質がリガンドと結合する部位を結合部位(binding site)と言う。通常はアミノ酸側鎖(鎖式炭化水素基)が特定の配置で表面に並んだためにできた凹があるが、その窪んだタンパク質の内部に埋め込まれた原子は、リガンドとは直接接触していないが、その骨組みが分子の表面に必要な凸凹を作り、その化学的性質を決定づける。そのため分子内部のアミノ酸に僅かな変化が生じても、三次元構造が変化しタンパク質の機能を失ってしまう。
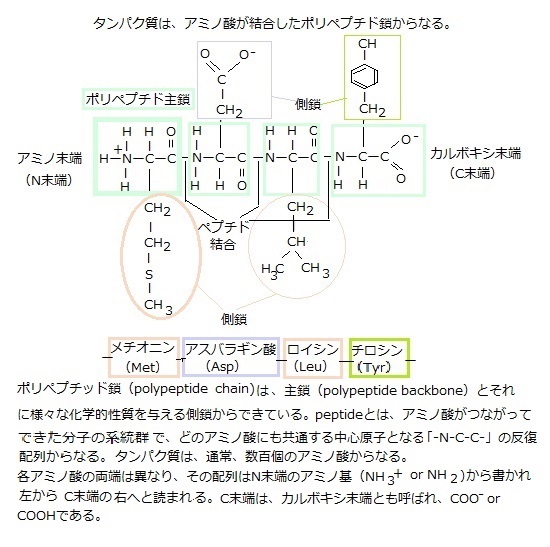
また、アミノ酸は、側鎖の違いにより区別される。
細菌・植物・動物のいずれも、タンパク質には同じ20種類のアミノ酸が使われている。
どうして、この20種類が選ばれたかは、生命進化の謎である。
分子の表面同士が余り一致しなければ、非共有結合は殆ど起こらない。その2個の分子が結合しても直ぐ離れてしまう。この仕組みで、本来の相手ではない分子相互の結合を回避している。
その一方で、タンパク質がリガンドと結合すると、その結合部位に多数の非共有結合が形成され、その構造により結合が極めて長く保たれ、その一群の巨大分子が生物機能には欠かせない存在となる。
タンパク質を合成し、遺伝暗号を翻訳するリボソームのような機能的な細胞内構造物が作られるのも、その例の一つである。
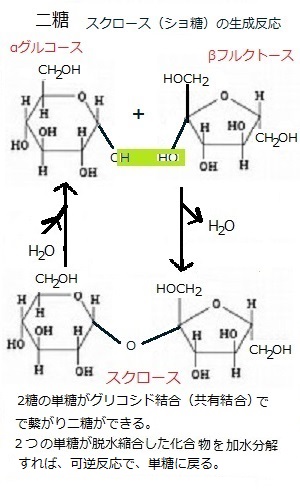
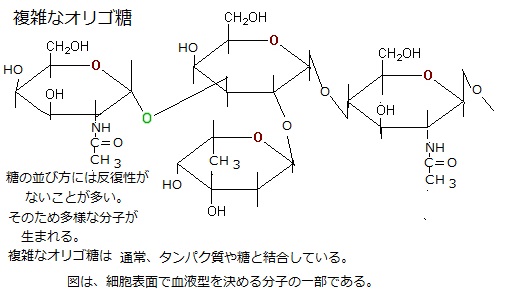
単糖はグリコシド結合という共有結合によって繋がり、大きな炭水化物を作る。
単糖が2個つながれば二糖である。例えば、スクロース(ショ糖)は、グルコースとフルクトースからなる二糖である。
糖の重合体には、三糖や四糖などのオリゴ糖(oligosaccharide;oligo・sáccharide)から、数千個の単糖からなる巨大な多糖まである。
「オリゴ」という接頭語は、少数の単量体(オリゴマー)という意味で、オリゴ糖は通常2~10からなる分子を指すのに対して、重合体(ポリマー)は、数百とか数千からなる単量体の集合体である。
糖の結合には、生化学反応で作られる結合に共通するいくつかの特徴がある。
ある糖の-OH基と別の糖の-OHとは、結合するときに水分子が1個とれる縮合反応(condensation reaction)によって結合する。
核酸やタンパク質などの生体高分子も、構成単位は水分子が取れると縮合反応で繋がっていく。
縮合反応でできた結合は、逆向きの反応、加水分解によって水分子を1個加えれば切れる。
目次へ
タンパク質が機能するためには、特定のリガンドとの結合が不可欠である。抗体(antibody; ˈænṭɪbὰdi)と結合するリガンドは無限に存在する。ヒトの体内では、考え得るどんな分子とも識別して結合できる、膨大な抗体分子を生産する能力を備えている。
抗体は、異分子や体内に侵入しようとする微生物の表面などに反応し免疫系が生み出す免疫グロブリンタンパクである。抗体は特定の標的と確実に結合し、その能力を不活性化したり、分解の必要性を示す標的になったりする。抗体はその標的分子、即ち抗原を極めて正確に識別する。ヒトが遭遇する抗原の種類は数十億に達するから、抗体もそれに相応の免疫グロブリンタンパクを生産する能力を秘めていることになる。
またタンパク質は、細胞構造の成分となり、チューブリンタンパクとして、細胞内で自己集合して長くて固い管状構造の微小管(microtubule)を作る。それは中空の筒となって、長く真っ直ぐ伸びて、通常は、「中心体」と呼ばれる微小管形成中心とくっついている。真核細胞では、細胞質の組織構築とその秩序を保ち、巨大分子や小器官の細胞内輸送に利用される。その微小管に結合する補助タンパクの微小管付随タンパクは、線維状の微小管を安定させ、細胞の他の構造と連結し、微小管に沿って様々な成分を輸送する。
細胞小器官のタンパク質の殆どは、細胞質で合成される。小胞体は、真核細胞内で一番広い面積を持つ膜だが、小胞体自身をも含めて細胞小器官へ送られるタンパク質の輸送を開始する。
ゴルジ体・エンドソーム・リソソームだけでなく、細胞表面に輸送されるタンパク質も含めて、全てのタンパク質が、細胞質から小胞体へ送られ、小胞体内腔や小胞体膜に入ったタンパク質は、二度と細胞質に戻ることなく、輸送小胞によって、それぞれが機能する細胞内膜系中の細胞小器官から細胞小器官へ、あるいは細胞小器官から細胞膜へと誘導される。細胞質で機能するタンパク質にはシグナルがないため、合成された場所にそのまま留まることになる。
ミトコンドリアや葉緑体のタンパク質も、殆どが細胞質で合成され、それらの小器官の膜にあるタンパク質転送装置を通って、各小器官内に能動的に運ばれる。転送装置を縫うように通る際にタンパク質の構造が解かれる。
ヒストンは、染色体を組み合わさって糸巻状の構造にし、DNAを小さくまとめる。ヒストンは極めて大量に存在し、細胞1個あたり数種類のヒストンが6,000万分子以上あり、染色体の中での総量はDNAと同じくらいある。これらタンパク質と核DNAとの複合体をクロマチンと呼ぶ。
核内のタンパク質には、核局在化シグナルがあり、細胞質から核膜孔を通って核内へ能動輸送される。核膜孔は、二重の核膜を貫通しているため、タンパク質は折り畳められた構造のまま核内へ運ばれる。
ミオシン(myosin)は、分子モーターとなって力を出したり運動を起こしたりする。多くの真核細胞は、繊毛や鞭毛を使って泳ぐのではなく、アメーバ運動で這いまわって移動する。単細胞の捕食性のアメーバは、食物を求めて這い回っている。発生途中の軸索では、先端が成長因子に応答して、化学シグナルによる道筋をたどって、最終的には情報を伝達する接合部分(シナプス;synapse)を作る細胞にまで進んで行く。
白血球の一種の好中球は、細胞から放出された小分子を嗅ぎ付け、血中から感染組織へと遊走し、細菌を取り込んで壊す。このハンターは、細胞表面の受容体に走行性分子が結合すると、アクチンフィラメントの会合状態を変化させ、獲物へ向かって進むのに役立てている。
様々な細胞が這い回るときの分子機構では、鞭毛のような単一の移動装置があるわけでなく、細胞の異なる領域にある多くの分子が協調して変化する。この変化には、相互に関係する3つの過程が重要である。
① 動きの前線となる先導部分から突起を出す。
② 細胞が進もうとしている面に突起が接着する。
③ この接着を足掛かりにして細胞の本体が前方に引きずられる。
この3段階の全てにアクチンが関係する。関与の仕方は異なるが、細胞表面を突き出す最初の段階は、アクチンの重合による。
アクチンは、真核細胞の細胞質の至る所で見られる。細胞膜直下の層に集中していることが多い。
細胞皮層(cell cortex)と呼ばれる領域では、アクチンフィラメントは、アクチン結合タンパクによって連結されて粗い網の目構造をなし、細胞膜を支えて機械的な強度を高めている。
例えば、ヒトの赤血球では、細胞膜にくっついて単純で規則的な線維状タンパクの網の目構造となって、この細胞の円板形を維持している。
このアクチンフィラメントの架橋された三次元の網目構造が、細胞膜の形状や機械的な特性を支配し、細胞の形や細胞表面の動きを支えている。この細胞皮層におけるアクチンフィラメントの並べ替えが、細胞の形状変化と移動の主要な分子基盤となっている。
細胞は、先端部に限らず、表面のあっちこっちに、糸状仮足(filopodium)と呼ばれる細くて硬い突起を伸ばすことがよくある。これらの幅は約0.1μm、長さが5~10μmで、10~20本のアクチンフィラメントの緩い束を含み、プラス端(単量体が方向性を持って重合する分子の一方で、多くの場合は伸長方向もしくは伸長速度が早い方の端)が外に向いている。
発生途中の神経細胞軸索の先端の「成長円錐」は50μmにもなる長い糸状の仮足を広げて辺りを探り、目標の細胞へ至る正しい道筋を見つけるのに役立っている。 平たい葉状仮足と糸状仮足は、どちらも1秒当たり約1μmという速さで、出したり引っ込めたりしながら探査する動的な構造である。
ともに細胞膜の近くでアクチンフィラメントが会合して、プラス端へアクチン単量体(細胞骨格と呼ばれる細いタンパク質線維)を付加することで、局所的に急速に伸長して形成される。これにより細胞膜は、アクチンフィラメントに破られず押し出される。アクチンフィラメントにより、動物細胞は移動できる。
アクチンフィラメントに富むアクチン皮層の張力で生じた力が細胞の前進を助ける。細胞の先導端で重合したアクチンが、細胞膜を前方へ突出させ、アクチン皮層領域を新たに作る。細胞の底面と、細胞が進んで行く面(基質)との間に新しい接着点ができる。細胞の後方部分が、アクチンフィラメントに沿って動くミオシンモータータンパクの動きで、滑らせ収縮させて、細胞本体を前方へ引き寄せていく。
細胞前方で新しい接着点ができ、後方では古い接着点が離れて、細胞は這い進む。このサイクルの繰り返しで、細胞はじりじりと前方へ動く。
アクチンと共に働くモータータンパクは、全てミオシンファミリーに属する。ミオシンは、複雑な線維構造をしており、ATP を加水分解する酵素活性を持ち、その加水分解エネルギーでアクチンフィラメント沿いにプラス端に向かって滑るように筋収縮を起こす。ミオシンなどのアクチン結合タンパクが、アクチンフィラメントの位置や組織化された構造、振る舞いを制御する仕組みなどの活性は、細胞外シグナルに制御されており、それにより環境に応じて自身のアクチン細胞骨格を作り直している。
最も単純なⅠ型ミオシンは、1個の球状頭部と尾部からなる。頭部はアクアチンフィラメントに付着し、尾部で細胞内の他の分子や細胞小器官と付着する。これによりミオシンの頭部が細胞膜に係留されているアクアチンフィラメントに沿って移動させ、逆に細胞膜に尾部を添わせてアクアチンフィラメントを移動させることもできる。またⅠ型ミオシンは、細胞皮層にあるアクチンフィラメントに結合して、それにより細胞膜を引っ張り変形させることもできる。
目次へ
 アクチン細胞骨格を制御する細胞外シグナル分子が、様々な細胞表面タンパクを活性化し、次にそれが各種の細胞内シグナル伝達経路を活性化する。この径路の多くは、Rho(ロー)タンパクファミリー(Rho
protein family)と呼ばれる、アクチン細胞骨格の組織構成をする。
アクチン細胞骨格を制御する細胞外シグナル分子が、様々な細胞表面タンパクを活性化し、次にそれが各種の細胞内シグナル伝達経路を活性化する。この径路の多くは、Rho(ロー)タンパクファミリー(Rho
protein family)と呼ばれる、アクチン細胞骨格の組織構成をする。よく似た単量体GTPアーゼの一群へと収束する。単量体GTPアーゼは、分子スイッチとなり、活性のあるGTP結合状態と不活性なGDP結合状態と行き来し細胞内の反応を制御する。
GTP結合タンパクは、結合していたGDPがGTPに交換されると活性化する。その後、このタンパク質は、結合したGTPをGDPに加水分解して、自らのスイッチをオフにする。 主要な細胞内シグナルタンパクの多くは、分子スイッチ(molecular switch)の役割がある。
つまりシグナルを受け取ると状態を切り替えて活性化し、伝達経路の他のタンパク質を刺激あるいは抑制する。そして何か他の過程によってスイッチが切れるまで活性状態を保つ。
スイッチを切る過程は重視されないようだが、伝達経路はシグナルを伝達した後は、元の状態に戻り次の伝達に備えなければならない。活性化した経路上のタンパク質は、全て活性化前の状態に戻る必要がある。そのため径路のどの活性化段階でも不活性機構があるため、いずれも情報伝達経路には不可欠な機能である。
分子スイッチとして働くタンパク質は、化学的修飾、即ちリン酸化によって活性化され、或いは不活性化する仲間もある。
タンパク質のリン酸化は、タンパク質の活性調節によく使われる機構である。標準的な真核細胞に含まれている数千種類のタンパク質は、共有結合により1個または複数のリン酸基の付加という修飾を受けている。
一般的な反応では、ATPの末端リン酸基を、リン酸化酵素のタンパクキナーゼ(protein kinase)の働きで、標的タンパク質のアミノ酸側鎖に共有結合される。
リン酸基の除去は、第2の脱リン酸酵素のタンパクホスファターゼ(protein phosphatase)により触媒された共有結合が除去されることである。
 チロシン側鎖の-OH基に付加したりする。リン酸化は、タンパク質の活性を増大させることも低下させることもある。それはリン酸化が起こる部位とタンパク質の構造による。
チロシン側鎖の-OH基に付加したりする。リン酸化は、タンパク質の活性を増大させることも低下させることもある。それはリン酸化が起こる部位とタンパク質の構造による。
タンパクキナーゼがスイッチタンパクにリン酸基を共有結合させるとスイッチがある方向へ動き、タンパクホスファターゼがリン酸基を外すと逆方向に働く。
リン酸による調節されるタンパク質の活性は、リン酸化するタンパクキナーゼと、脱リン酸化するタンパクホスファターゼの活性の瞬間ごとのバランスにかかっている。
リン酸化によって調節されるスイッチタンパクの多くは、自分自体がタンパクキナーゼなので、リン酸化連鎖反応が起りやすい。リン酸によって活性化したタンパクキナーゼが、次のタンパクキナーゼをリン酸化するという繰り返しでシグナルが先に送られ、その間に増幅・統合・配分・調節が起きる。
細胞表面にある受容体タンパクが、細胞外シグナルを細胞内シグナルに変換して、1つあるいは複数の細胞内シグナル伝達経路を働かせ、シグナルを細胞の内部へ伝達する。
リン酸化によって調節されるスイッチタンパクの多くは、自分自体がタンパクキナーゼなので、リン酸化連鎖反応が起りやすい。リン酸によって活性化したタンパクキナーゼが、次のタンパクキナーゼをリン酸化するという繰り返しでシグナルが先に送られ、その間に増幅・統合・配分・調節が起きる。
細胞表面にある受容体タンパクが、細胞外シグナルを細胞内シグナルに変換して、1つあるいは複数の細胞内シグナル伝達経路を働かせ、シグナルを細胞の内部へ伝達する。 細胞内シグナル伝達経路に関わるスイッチタンパクのもう1つが、GTP結合タンパクで、このスイッチの活性状態と不活性状態は、それぞれGTPとGDPのどちらに結合しているかによって決まる。
このタンパク質は、GTP加水分解(GTPアーゼ)活性を備えており、GTPの結合によって活性化された後、結合したGTPをGDPに加水分解して自らのスイッチを切る。 細胞内シグナル伝達経路に関わるスイッチタンパクのもう1つが、GTP結合タンパクで、このスイッチの活性状態と不活性状態は、それぞれGTPとGDPのどちらに結合しているかによって決まる。
このタンパク質は、GTP加水分解(GTPアーゼ)活性を備えており、GTPの結合によって活性化された後、結合したGTPをGDPに加水分解して自らのスイッチを切る。
多細胞生物の専門化した細胞は、細胞外のシグナルに応じて遺伝子の発現パターンを変える。肝細胞がステロイドホルモンの一つ、コルチゾールに出合うと、いくつかのタンパク質の生成が著しく増大する。コルチゾールは、飢餓や激しい運動など、長期のストレスが重なれば副腎から分泌される。
例えば、アミノ酸などの低分子からグルコースを作るように肝細胞に合図する。それにより、チロシンをグルコースに変換するチロシンアミノ酸基転移酵素などを増加させる。やがてコルチゾールが減少するにつれ、タンパク質の生成が安静状態に戻る。 細胞の種類が違えば、コルチゾールに対する反応も違う。
脂肪細胞では、チロシンアミノ基転移酵素の生産は減少する。その一方では、コルチゾールに全く反応しない細胞もある。細胞が種類が異なれば、同じ細胞外シグナルに対する応答の仕方にも、当然、違いが生じる。これが細胞の専門化の一因となり、個々の細胞の独自性に繋がっている。
(コルチゾールcortisol 受容体)
細菌では、一群の遺伝子の発現を協調させるのに、1個のプロモーターが制御する1つのオペロン(同一オペレーターによって同時に調節される一組の構造遺伝子)に複数の遺伝子をまとめる仕組みがある。
真核細胞では、すべてをまとめる遺伝子がなく、遺伝子は個々に転写され、個々に転写調節因子共働体が働いている。それでは遺伝子発現における全体の協調はどうなっているのだろう。
実は、遺伝子の発現が組み合わせによって調節されていても、1個の転写調節因子が、遺伝子のオン・オフの決定権を握っている。
個々の遺伝子の活性あるいは抑制に必要な組み合わせを、この因子が最後に完成させている。異なる遺伝子でも調節に必要な組み合わせの最後に同じタンパク質を使っていることもある。異なる遺伝子であっても、同じ転写調節因子を識別する調節DNAが含まれてさえすれば、この因子によって、ひとまとめに発現をオン・オフにできるのだ。
原核生物や真核生物のいずれも、その細胞は、個々にオン・オフするだけでなく、異なる遺伝子の発現が協調されなければならない。そのため、真核細胞が「分裂せよ」というシグナルを受信すると、それまで発現しなかった多数の遺伝子が活性化し、細胞分裂を誘発する。しかし、各遺伝子の調節配列に、異なった遺伝子活性化因子が結合するだけでは、それらの結合タンパク質の転写後の活性化効率は悪いので、もう1つの別の転写調節因子、即ち活性化したコルチゾール受容体複合体が、各遺伝子すべての調節配列に結合する。
その別の転写調節因子である1個のタンパク質が、異なる遺伝子の発現を協調させることができる。実は、遺伝子の発現には、今まで発現していなかった多数の遺伝子の組み合わが一斉に働かなければならない。そのため、1個の転写調節因子が、ある遺伝子のオン・オフの決定を握り、その遺伝子の活性化とその抑制に必要な組み合わせを、この因子が最後に完成させる。
異なる遺伝子でも、調節に必要な組み合わせのために、最後に同じタンパク質を使っていれば、同じ転写調節因子が識別する調節DNAさえ含まれていれば、この因子によって、同時にまとめて発現をオン・オフにできようになる。
ヒトでは、コルチゾール受容体タンパクにより、この調節が行われている。この転写調節因子が、まずコルチゾールと複合体を形成しないと調節部位に結合できない。
肝細胞は、コルチゾールに応答して様々な遺伝子の発現を上昇させる。
遺伝子は、すべてコルチゾール受容体複合体が、個々の遺伝子内の調節配列に結合することによって、制御されるコルチゾール濃度が再び低下すると、すべての遺伝子の発現は正常レベルに戻る。
1個の転写調節因子で、多数の遺伝子の発現を調節して協調させている。 限られた数の転写調節因子を使って多数の遺伝子のスイッチを切り替え、遺伝子を発現する仕組みは、肝細胞などの機能の調節に働くだけでなく、真核生物の細胞が胚発生(多細胞生物が、受精卵から成体になるまで)を経て特定の細胞に分化する過程でも重要な役割を果たしている。発生過程では、少数の転写調節因子の組み合わせで、数多くの細胞が誕生している。 実験の段階では、培養した肝細胞に3種類の神経特異的な転写調節因子を人為的に組み込みニューロンへと変換させている。どのような転写調節因子を組み合わせかの研究により、各種細胞が作られるようになるだろう。
ヒトでも、コルチゾール受容体タンパクに、このような調節が見られる。これも転写調節因子だが、まずコルチゾール受容体複合体を形成しなければ、調節部位に結合できない。
多細胞生物の専門化した細胞は、細胞外のシグナルに応じて、遺伝子の発現パターンを変える。例えば、肝細胞が、ステロイドホルモン(コレステロールの誘導体の一種)の1つコルチゾールに出合うと、いくつかのタンパク質の生産量が著しく増え、様々な遺伝子の発現を上昇させる。コルチゾールは、飢餓や激しい運動や長期のストレスの際に副腎で作られ分泌されるストレスホルモンの1つで、アミノ酸などの低分子からグルコースを作るよう肝細胞に合図すると、コルチゾールが副腎から分泌される。また、アミノ酸などの低分子からグルコースを作るよう肝細胞に合図すると、例えば、アミノ酸の一種のチロシン(細胞でのタンパク質を生合成する20のアミノ酸のうちの1つ)をグルコースに変換するチロシンアミノ基転移酵素などの酵素が増加する。肝細胞は、コルチゾールに応答して、様々な遺伝子を発現する。これらの遺伝子すべても、コルチゾール受容体複合体が、個々の遺伝子の調節配列に結合することにより制御されている。
コルチゾールが無くなると、これらのタンパク質の生産は正常に戻る。
受容体タンパクはコルチゾールが結合すると活性化して、DNAの特定の調節配列に結合できるようになり、特定の標的遺伝子の転写を活性化する。細胞の種類が違えば、抑制因子としても働く。
コルチゾールなどいくつかのステロイドホルモンの受容体は、細胞質に存在するが、他のステロイドホルモンや甲状腺ホルモンの受容体は、ホルモンがやってくる前から核内のDNAに結合した状態で待機している。ステロイドホルモンは一般に生殖腺や副腎においてコレステロールから合成され、それらのホルモン分子の構造は脂質であり、それらは細胞膜に達すると、容易に内部に通過し細胞核へ到達する。
スポーツなどで、その投与がドーピング問題として取り上げられる「ステロイド」は、ステロイドホルモンと同様、あるいはそれより強力なホルモン作用を持つ人工的に合成されたステロイドである。
遺伝子はすべて、コルチゾール受容体複合体が、個々の遺伝子内の調節配列に結合することによって制御される。コルチゾール濃度が低下すれば、すべての遺伝子の発現は安静状態に戻る。この一個のコルチゾールという転写調節因子で、多数の遺伝子の発現が協調させられている。
細胞の種類が違うと、コルチゾールに対する反応も違う。肝細胞はステロイドホルモンの1つコルチゾールに出合うと、アミノ酸からグルコースを作るよう合図されるので、チロシンをグルコースに変換するチロシンアミノ基転移酵素が増加する。逆に、脂肪細胞ではチロシンアミノ基転移酵素の生産を減少させる。またコルチゾールに全く反応しない細胞もある。細胞の種類が違えば、同じ細胞外シグナルに対する応答の仕方も違うことも多く、これが細胞の専門化の一因となっている。そのため、細胞それぞれが独特の特徴を作り出しいく。
限られた数の転写調節因子を使って多数の遺伝子のスイッチを切り替える仕組みは、通常の細胞機能の調節に役立つばかりか、真核生物の細胞が胚発生を経て、特定の細胞へ分化いていく過程でも役割を担っている。その顕著の例が、筋細胞の発生である。
哺乳動物の典型的な骨格筋細胞は他の細胞と大きく異なり、細胞質ゾル(サイトゾル;cytosol;細胞質基質)にとどまる筋収縮装置を構成する2種類の収縮タンパク質であるアクチンとミオシンや、受容体タンパク、筋細胞を神経刺激に対して感受性にする細胞膜のイオンチャンネルタンパク(膜貫通タンパク質の一種で、受動的にイオンを透過させるタンパク質の総称)など、特徴があるタンパク質を数多く持っている。
目次へ

細胞内に取り込まれた細胞外の粒子や分子の多くは、最後にリソソーム(lysosome)に送られる。膜で囲まれた袋状のリソソームには、タンパク質・核酸・オリゴ糖・脂質などを分解する40種類ほどの加水分解酵素があり、細胞外から取り込まれた物質や老化した細胞小器官の細胞内消化を調節しながら進めていく。
リソソーム内の酵素は、酸性条件でのみ活性化する。リソソーム内の酸性環境がほぼpH5で最大活性状態になる。そのリソソーム内腔のpH5は、膜にあるATP駆動H+ポンプが、ATPを加水分解してH+を内腔に取り込むため酸性が保たれる。
リソソームの膜は、これらの加水分解酵素を、ほぼpH7.2にある細胞質から隔離しているが、万一酵素が漏れ出しても、酵素の至適pHが酸性なので、細胞質の内部では働けず被害が及ばない。
細胞には、リソソームに物質を供給する径路が他にもあり、オートファジー(autophagy)と呼ばれている。この径路も細胞の老廃物の分解に使われ、自食作用と言うように、細胞が文字通り自分を食べるように分解する。
二重膜が細胞小器官を包み込んで自食胞を作り、それがリソソームと融合する。細胞小器官の自食作用と細胞質のタンパク質は、真核細胞が飢餓状態になったり、発生の間に広範囲にわたる細胞の再生が行なわれたりした際に増加する。
この自食作用によって生じたアミノ酸は、再利用されタンパク質合成が継続的に行われるようになる。
消化によってできた有機小分子は、細胞質に入り、そこで緩やかな酸化的分解がなされる。第一段階では、主に口や胃腸による細胞外で起こるが、細胞内のリソソームでも大型有機分子が消化される。
リソソームは、消化酵素を含んだ微細な袋で、不要になった細胞小器官やエンドサイトーシス(endocytosis;飲食作用)により細胞が取り込んだ巨大分子や粒子を分解する。
リソソームまでの径路は、物質の出所により異なる。細胞外の粒子は、食胞に取り込まれ、その食胞がリソソームと融合する。細胞外液と巨大分子は、小型のエンドサイトーシス小胞に取り込まれて、選択的透過性を持つエンドソームという一連の小区画をまず通過してからリソソームに送られる。エンドソームは、取り込んだ分子を選別し、一部を再利用するため細胞膜に送り返す。
膜に包まれた細胞小器官は、真核細胞内の至る所にあり、それぞれ特定の役割を果たす。細胞質内の細胞小器官の外側を満たす水溶液を「細胞質ゾル」と呼ぶ。細胞小器官であるリソソーム・小胞体・ゴルジ体などと、細胞外部の間では、絶えず物質の交換が行われている。小さなシャボン玉が大きなものから分かれて、離れた別のシャボン玉と合体するように、細胞小器官の袋から、くびれて離れた輸送小胞が、別の細胞小器官と融合して、交換を仲介する。
例えば、ゴジル体の細胞表面で、その細胞膜の一部が陥入して、くびり取られるように小胞となり、細胞膜との融合を促すシグナルが来るのを待つ。食胞に摂取され、細胞膜に閉じ込められた細胞外の物質は、細胞膜の一部に徐々に取り囲まれ、そこが内側に陥入して首切られて、細胞内に運び入れられエンドサイトーシス小胞ができる。
それには膜の成分も含まれているが、1枚の膜で細胞質と隔てられる細胞小器官のエンドソームに送られ、細胞膜に戻され再利用されるか、リソソームに送られ消化される。
消化されて生じた代謝産物は、リソソームから直接細胞質に運び出され再利用される。これが「飲食作用」、即ち「エンドサイトーシス」である。これにより動物細胞は、巨大な粒子ばかりか、細胞さえ丸ご飲み込む。この逆が「開口分泌」、則ち「エキソサイトーシス(exocytosis:開口分泌)」である。真核細胞は常に、エンドサイトーシスにより細胞外物質を取り込み、エキソサイトーシスにより細胞内物質を放出する。
細胞内の小胞は、細胞膜と融合し、その内容物を細胞外へ放出する。細胞は、細胞間の伝達に関わるシグナル伝達分子やホルモンの大部分を、このエキソサイトーシスから放出する。
真核細胞では、エキソサイトーシスにより、小胞が常時、トランス面(放出面)が細胞膜側に向いているトランスゴジル網から出芽して細胞膜と融合する。ゴジル体は、膜で囲まれた扁平な袋(嚢)が、皿のように積み重なった構造(層板)であり、通常、細胞核の近くにあって、動物細胞では、細胞の中央にあるタンパク質線維系の、小さな細胞骨格構造の「中心体」に近接していることが多い。1つの層板は、3個から20個程度の嚢からなるが、ゴジル層板の数は、細胞の種類で大きく異なり、大型の層板が1個だけのものと、極めて小型の数百個を備えるものなどがある。
小胞体でタンパク質に付加されたオリゴ糖鎖の大半は、そのゴジル体で更に修飾される。小胞体では、タンパク質に糖が1個ずつ付加されてオリゴ糖鎖ができるのではない。前もって準備された14個の糖から枝分かれしたオリゴ糖が、糖鎖付加部位を持つ全てのタンパク質に一度に付加される。タンパク質によっては、ゴジル層板を次々と通過する間に、一連の酵素群によって厳密に決まった順序で糖が付加されたり切除されたりする整然とした反応で複雑なオリゴ糖鎖が形成される。
その一連の糖処理の過程でも、酵素が働く。初期に働く酵素は、シス面(cis face受入面)に近い嚢にあり、後期に働く酵素は、トランス面に近い嚢に存在する。その各トランス面の最も外側の嚢(トランス嚢)は、管状や小胞状の膜が相互に繋がった複雑な網目構造になっている。水溶性のタンパク質や膜は、小胞体から生じた輸送小胞によってシスゴジル網に入る。タンパク質は1つの嚢から出芽して次の嚢に融合する輸送小胞によって運ばれ、次々と嚢内を通過して行く。細胞表面や他の細胞内膜系に属する小器官に向かうタンパク質は、輸送小胞に入って最末端のトランスゴジル網から運び出される。
シスゴジル網とトランスゴジル網は、どちらもタンパク質の選別に重要な役割を果たしている。シスゴジル網に入ったタンパク質は、ゴジル層板を通過して先へ進む。小胞体保留シグナルを持っている場合は、小胞体へ戻される。
トランスゴジル網から小胞により運び出されたタンパク質は、エンドソーム経由でリソソームへ向かうか、それとも細胞表面へ向かうか、選別される。真核細胞では、エキソサイトーシスにより、小胞は、常時、トランスゴジル網から出芽して細胞膜に融合する。この構成性エキソサイトーシス径路が、新たに合成された脂質やタンパク質を細胞膜に補給する。細胞は、分裂し拡大する前に、これにより細胞膜を拡大し、増殖の必要がなければ、古い脂質やタンパク質を更新する。
タンパク質には、様々な形と大きさがある。酵素は、球状のものが多い。酵素は複数のサブユニットからなる複雑で大きな構造のものが多い。全体的には球状の四次元構造を持っている。一方、役割上、細長い単純な三次元構造を持つタンパク質も多い。これをまとめて線維状タンパク(fibrous protein)と呼ぶ。 線維状タンパクは、細胞外部に特に豊富で、ゲル状の細胞外マトリックス(matrix;基質)を形成し、細胞同士を結びつける組織を作るのに役立っている。これは細胞が自分の周囲に分泌したもので、シートや長い線維になっている。なかでもコラーゲンは、動物組織の細胞外線維状タンパクとして最も大量に存在する。多数のコラーゲン分子が、横並び縦並びに繋がり、「コラーゲン原線維」と呼ばれる長い構造体を作っている。このゴムのような弾性線維のおかげで、皮膚や動脈、肺などの組織が伸縮自在となって破れないような構造になっている。その弾力性は、伸びるたびに個々のタンパク分子の構造が、可逆的に解けるために可能になっている。
エラステン分子は、互いに共有結合の架橋を作ってゴムのような弾性線維となっている。張力が加わると、個々のエラステンポリペプチド鎖のコイルは解けて伸びた構造になる。張力が弱まれば自然に元に戻る。
真核細胞では、エキソサイトーシスにより、小胞が常時、トランスゴルジ網から出芽して細胞膜に融合している。この構成性エキソサイトーシス径路が、新たに合成された脂質やタンパク質を細胞膜へ補給している。細胞は、分裂に先立って細胞膜を拡大し、増殖が行なわれなければ古い脂質やタンパク質を更新することになる。
細胞表面へと水溶性タンパクを運んで外部に放出する分泌(secretion)も、この構成径路で行われる。細胞からは、多数の水溶性タンパクが、全ての真核細胞に備わる構成性分泌径路を通って絶えず分泌されている。この径路では、新たに合成された脂質やタンパク質を細胞膜へ供給している。
放出されたタンパク質の中には、細胞表面に付着したままになったり、あるいは細胞外マトリックスに取り込まれたり、細胞外液に拡散して栄養として使われたり、他の細胞のシグナル役になりもする。この構成径路に入るには、タンパク質をエンドソームに運び径路や、小胞体に戻す径路と同じように、特にシグナルは必要としない。
真核細胞では、構成性エキソサイトーシス径路は、たゆまず働いているが、それ以外に調節性エキソサイトーシス径路があり、分泌専門の細胞だけに備わっている。分泌細胞は、ホルモン・粘液・消化酵素など特定の物質を量産し、分泌小胞に蓄えたうえで放出する。分泌小胞は細胞内膜系の一部で、トランスゴルジ網で選別された分泌タンパクが、分泌小胞に詰め込まれて調節性エキソサイトーシス径路に入る。この段階では、トランスゴルジ網内に形成された分泌小胞内で、タンパク質は濃縮され、分泌を指示する細胞外からのシグナルで刺激されるまで蓄えられている。そこで会合した分泌タンパクの内、特定のものだけが分泌小胞内で分離される仕組みは明らかではないが、その分泌小胞内には、独自のタンパク質があるので、それが分泌タンパクの受容体になっていると考えられている。
トランスゴルジ網から出芽すると、調節を受けるエキソサイトーシスとして細胞膜近くに集まる。そのエキソサイトーシスが、細胞の外部からホルモンや神経伝達物質のような刺激シグナルを受けると、細胞膜と融合した内容物をエキソサイトーシスにより細胞外へ放出する。
血液中のグルコース濃度の上昇が、膵臓内分泌細胞へのシグナルとなってインスリンの生産を指示する結果、インスリンは分泌小胞に、会合していない場合よりも200倍に達する高濃度で濃縮される会合状態で蓄えられるのが、その例の一つである。そのため分泌されたホルモンのインスリン会合体は、直ちに血液中に溶け込む。 分泌小胞や輸送小胞が細胞膜に融合し、エキソサイトーシスによって、会合した内容物が放出されると、小胞の膜は細胞膜の一部になる。そのため細胞膜の表面積は大幅に増えるが、別の場所で働くエンドサイトーシスにより、エキソサイトーシスで増加する、ほぼ同じ速度で膜が取り除かれる。膜が取り除かれる際の小包膜の脂質とタンパク質は、ゴルジ網に回収され、そこで再利用される。
細胞内に取り込まれた細胞外の粒子や分子の多くは、最後にリソソームに送られる。膜で囲まれた袋状のリソソームには、加水分解酵素が含まれており、細胞外から取り込まれた物質や老化した細胞小器官の細胞内消化を、調節しながら進めていく。リソソームには、タンパク質・核酸・オリゴ糖・脂質などを分解する40種類の加水分解酵素があり、これらの酵素は、リソソーム内部が酸性環境で活性化し、濃度がpH5で最大活性を示す。細胞質のpHは、7.2程度という。
リボソームの膜には、輸送体があって、巨大分子を分解した最終産物であるアミノ酸・糖・ヌクレオチドなどを細胞質に搬出する。細胞は、これらを外部に排出したり、細胞内で再利用したりする。
なお、ほぼ全ての真核生物の細胞質に見られる、小型の細胞小器官であるベルオキシソーム(peroxisome)にも、脂質の分解や有毒物質の破壊など様々な酸化反応に関わる酵素が含まれている。
殆どのタンパク質や酵素は、細胞内で持続的に、しかも最大速度で働いているわけではない。タンパク質の活性は、細胞が最適な状態を維持し、時々の条件下で自らの生存に必要な分子だけを生産するよう巧妙に制御されている。タンパク質を時にどれだけ働かせるかが重要な調節で、細胞は貯蔵され基質(酵素の作用を受ける分子)の無駄な消費や、不必要な分子を蓄積させてまで予備のエネルギーを無駄に消耗させないように、個々の細胞は、タンパク質と酵素の活性を制御する。
細胞は、タンパク質の合成を指令する遺伝子の発現までも調節し、更にタンパク質が分解する速度を調節することで、細胞内に生成されるタンパク質の量も調節する。しかも、細胞は、複数の酵素を一纏めにして膜で囲った区画に閉じ込めることで、酵素活性を調節する。しかし、タンパク質の活性を調節する有効にして手早い方法は、自らのタンパクレベルの調節である。タンパク質は様々な方法で、遺伝子の発現を制御できるように、スイッチをオン・オフにするためのタンパク質の形状を変えている。
目次へ