| Top 車山高原 車山高原お知らせ 車山ブログ
|
 コオニユリは、 車山高原の陽光に育まれて、7 月頃から咲く美しい花! コオニユリは、 車山高原の陽光に育まれて、7 月頃から咲く美しい花!このように雌ずいと雄ずいが、極端に飛び出す花(雌雄離熟)は珍しい! なぜが、それぞれが、よそよそしい。 これが、他家受粉に種の保存をかけたコオニユリの進化した姿のようだ。 コオニユリは、実生から6~8年経たないと開花しない。鱗茎はヤマユリと同様、ユリ根として食用となる。 オニユリは葉の腋に珠芽(むかご)を作るが、コオニユリには生じない。 |
| 目次 |
| 1)花の進化と生殖 |
| 2)植物細胞におけるミトコンドリアのゲノム |
| 3)細胞質雄性不稔 |
| 4)配偶体型自家不和合性(GSI) |
| 雄性先熟(写真はキキョウ) 雌期が先行する。 アブラナ科やウマノスズクサ・オオバコ・ ツリフネソウなども、雌期が先行する。 |
 |
| キキョウは、雌ずいが、最初に発現する |
 |
| 柱頭の成長が停滞し、雄ずいが現れる |
 |
| そのまま雄ずいが発育する |
 |
| やがて雄ずいが萎える |
 |
| 雄ずいが機能しなくなると、雌ずいが活性化する |
他殖は、遺伝子の組合せのバリエーションが広がることを意味する。つまり、種としての適応と耐性の増大に繋がる。また近交弱勢を避けることにもなる。さらに自己の花粉を他の花に渡すことは、自らの遺伝子の拡散に繋がる。
被子植物は、ふつう両性花であるため、自家受粉が起こりやすいように思えるが、実際には、様々な方法で自殖を避けている。同じ株の花粉が柱頭に付着しても、花粉は受精されず、そのため花粉管の発芽や伸張が起きない自家不捻性の仕組みができている。
1つの株に多数の花が同時に咲くと隣家受粉の可能性が高くなる。隣家受粉は遺伝的に自殖と同じであるため、時間差を置き散発的に開花することによって隣家受粉をある程度避けるようとする。
両性花の中で雄しべと雌しべの位置や構造が自家受粉の障害となる雌雄離熟 herkogamyの種がある。キツネユリ (イヌサフラン科) は、コオニユリと同様、葯と柱頭が離れているため、自家受粉ができない。ナデシコ (ナデシコ科) ・ギボウシ・ニッコウキスゲ・ツリガネニンジンでは、雄しべよりも柱頭が花柄から極端に突出すため、花粉が自らの柱頭に落ちることはない。ラン科では花粉が花粉塊を形成するため、送粉者を介さなければ受粉できないが、必ず他家受粉が起こる仕組みになっている。
被子植物の大多数の85%以上は両性花をつける。18世紀の終わりにChrstian Konrad Sprengelは、「大多数の被子植物の花は、花粉媒介者となる昆虫を誘引するのに最適化された形をしており、これらの媒介昆虫は、自殖よりも他殖を促進する」という。
両性花や雌雄異花いずれも、自家受粉を避けるような時空間的な特徴をもっている。
雄ずいと雌ずいの成熟時期が異なる雌雄異熟dichogamy(daikɑ'gəmi)という性質がある。これには、雄性先熟protandryと雌性先熟protogynyの2種類がある。
雄性先熟の花は、雌ずいより雄ずいの方が先に成熟し、雌性先熟では、雄ずいより前に雌ずいが成熟する。雄性先熟の花では、葯からの花粉放出は、柱頭が開放され受容能が獲得される前に起こり、雌性先熟の花では、柱頭の開放は、花粉の放出に先んじてしまう。ただ、通常の環境では、その種が植生する自然集団内には、いつの時点でも発生段階の異なる個体が存在するので、どの雌ずいにも合う時期の花粉があり、花粉も、どこかには合う雌ずいに出合うことになる。
他殖を促進する花の特徴としては、他に異花柱性heterostylyというものがある。hetero(hétəròu)は、「異質な」の意で、stylyはstyle(stὰɪl;様式)の接尾辞である。
この型はキク科やアブラナ科などにみられる異型不和合性である。異花柱性に典型的な例が、長・短2型の雌ずいと雄ずいの組合せを持つ二形花柱性 (distyly)の植物、例えばソバ・サクラソウ・レンギョウなど、長・中・短の3型の組合せをもつ三形花柱性 (tristyly)の植物、エゾミソハギ・アサザ (ミツガシワ科)やカタバミ属の種などなどの場合である。
このような植物種では、モルフmorph(mɔ'ːrf:形態)と呼ばれる2~3種類の特徴的な花をつける個体が同一集団内に存在し、モルフごとに雄ずいと雌ずいの長短が異なる。
2種類のモルフでの雌ずいと雄ずいの長さは、それぞれ異なる花粉媒介者による受粉や、同じ媒介者でも異なる体部位による受粉に適応して、他殖が誘発される。解剖学的に異なる2種類の花、長花柱のモルフと短花柱のモルフが作られた場合、異花柱性同士は自家不和合性も備え、異なるタイプの花の間でなければ、受粉されても受精しない。
また木本では他殖をするものが多いといわれている。
花は種によって自殖か他殖のどちらかを主とするが、一方だけに特化しているものはあまり多くないようだ。一年草は生育期間が1年と短いため、身近なイネ・ダイズ・コムギ・トマトなどの作物でも、確実性を重視して自殖・他殖の両方が可能である。また、越年草のムラサキケマン(ケシ科)やホトケノザ(シソ科)は、主に他殖を行う開放花と自殖のみをおこなう閉鎖花を同時につける。ムラサキケマンやホトケノザの種子は、栄養価の高いエライオソーム(オレイン酸などの脂肪酸、グルタミン酸などのアミノ酸、ショ糖などの糖)が付着する典型的なアリ散布植物である。
植物の花というのは、開花して受粉するのが普通、つまり、花は「受粉して、結実するために開花する」。ところが、植物の中には、決して開花することのない花がある。植物学上は「閉鎖花」という。スミレがそのいい例で、閉鎖花には、スミレ属 (スミレ科)の他、ツリフネソウ (ツリフネソウ科)・ムラサキケマン・ホトケノザ (シソ科)・センボンヤリ (キク科)、フタリシズカ(センリョウ科)・ヤマカタバミ(萼が開かない閉鎖花が多い)などの他、ランや肉食食物にもこの種がある。イネも開花はするが、その前に自花受粉が行われ、この「閉花受精」により交雑を防ぐ。
開放花と閉鎖花を時間的・空間的に使い分けていることが多い。またマルバツユクサ・ミゾソバ・ヤブマメなどの閉鎖花の中には、地中につけるものもある。
スミレも通常の受精も行ない、春にきれいな紫の花を咲かせ、他のスミレと他殖して実を付ける。春の花弁のある花は開放花で、ハナバチなどの「虫媒(ちゅうばい)」により他殖して種子を作る。動物のように移動が困難であるため、遺伝的に多様な形質を持つことにより、環境の変化に適応進化し、子孫を作る戦略を練る。
そのため草花の多くは、その遺伝子の数では、ヒトに近く、カーネンションは、ヒトを超えている。
スミレの閉鎖花は早春に咲くが、その後も夏から秋にも花を付けている。その後は、花弁のない蕾のような状態のまま、自分の花粉で実を結ぶため花は目立たない。自家受粉するため、遺伝的には同じ形質を持ち、少ない労力でたくさんの子孫を作るのに役立つ。そのため、スミレは八島ヶ原湿原をはじめ霧ヶ峰高原・車山高原に小群生地を作る。
帰化植物も、最初は少数個体の環境下で、繁殖が必要になるため自殖をするものが多い。ツメクサ(ナデシコ科ツメクサ属)やシロイヌナズナのように、花の直径が僅か1~2㎜程の小さな植物は、昆虫や風に頼る送粉を止めた典型的な同花受粉である。越年草のコハコベ (ナデシコ科) やタネツケバナ (アブラナ科) のように葯と柱頭が接しているため、葯から出た花粉が直接柱頭に付くものが多い。コハコベの雄しべは、雌しべの花柱を真ん中にして集まっている。コハコベ は、花を閉じる時に、雄しべが雌しべに接触して同花受粉することによって、受粉を確かなものにする。
タネツケバナは、放置された畑地や都市の人工的な荒れ地、或いは崩壊地や河川敷のような裸地的な場所にパイオニアとして侵入することが殆どで、1個体のみで繁殖しなければならないことも多い。同花受粉花はそうした条件下において、種子生産を最大にするメカニズムとして進化した。
またツユクサ (ツユクサ科) やオオイヌノフグリ (オオバコ科) のように、開花時には葯と柱頭が離れていても、閉花時などに葯や柱頭が近づいて互いに接するようになるものもある。これら自動同花受粉する花も、目立つ花弁・蜜・匂いなどを備えており、他殖の余地を残している。
スミレは日当たりのよい草地や高原、道端などに生える多年草で、種間雑種ができやすい植物で、野外でもよく探せば交雑種が見つかる。スミレの変異を複雑にしているのが、外来種が野外で少なからず繁殖していることである。
スミレは、車山高原の早春の野に、可憐な紫色の花を咲かせるが、春もたけなわの頃になると、紫色の花とは別に緑白色の未熟児のような花をつけるようになる。
注意して観察すると、紫の花は花茎が長く伸びて、葉より高く抜き出て開花するが、緑白色の花は一見つぼみの状態のままで決して開花することなく、花茎も伸びず、葉よりも高く抜き出ることはない。
スミレ・ムラサキケマン・ホトケノザ・カタクリ・ケシ・アケビ・シソなどの種子は、アリも散布に協力する。アリが好むゼリーのような甘く栄養価の高いエライオソームが付着しているからだ。種子は巣に運ばれるが、発芽に影響の無い好物のみ食べられ、種子はそのまま巣の中に放置される。その土壌は、有機物が豊富で肥沃、至適な湿度、なにより外敵の侵入から守られていろ。まさに種子の発芽には理想的な場所である。
スミレの果実は、若いときは下向きであるが、中の種が成熟すると上を向き、3つの果皮片に分かれる。果皮片は堅く、舟型をしており、その中には2・3列の種子が入っている。殻は見かけよりはずっと硬い。天気の良い日、硬い殻が3つに割れて開くと、多くの小さな種がむき出しになる。やがて3つに割れた殻のそれぞれがきつく狭められ、その圧力で殻が種を強く圧迫して、種は勢いよく飛ばされる。
| 雌雄離熟とは、雌ずいと雄ずいが離れた位置にあり、 雌雄異熟では、葯と柱頭の成熟に時間差がある。 | |||
 |
 |
 |
 |
| エゾカワラナデシコ | ニッコウキスゲ(ユリ科) | ツリガネニンジン(キキョウ科) | オオバギボウシ(ユリ科) |
植物細胞には、核ゲノム以外にミトコンドリアのゲノムmitochondrial genomeと色素体のゲノムplastid genomeの2つがある。その色素体の内、特に光合成を行うよう分化したものが葉緑体chloroplastである。
この2つの細胞質ゲノムは、別の原核細胞(核を持つ細胞を真核細胞と言うが、細菌のように、細胞内に真の核nucleusを持たない細胞。)にのみ込まれた細菌細胞のゲノムが進化したことによる。
最初のミトコンドリアは、酸素を利用する好気的細菌が、別の原核細胞に取り込まれ、それ以来ミトコンドリア自体で分裂することによって増殖し維持されてきた。やがて、その細胞内共生体は、進化の過程で、単独では生存できない細胞内小器官としておさまった。またダイナミンdynamin(GTPaseという一群の酵素タンパク質に属し小胞の形成に関わる)と共に働く植物独自のミトコンドリア分裂因子 (ELM1) も同定されている。この過程の最中、宿主となった細胞は、細胞内のその共生体のおかげで、好気的な代謝で酸素を利用できるようになった。この系譜にある細胞が、後に、すべての動物細胞へと分岐し進化した。
但し、ミトコンドリアの形状は、動物や酵母のものでは比較的細長い形状や分岐した形態をしているが、 植物ミトコンドリアでは粒状で、そのかわり数が非常に多い。
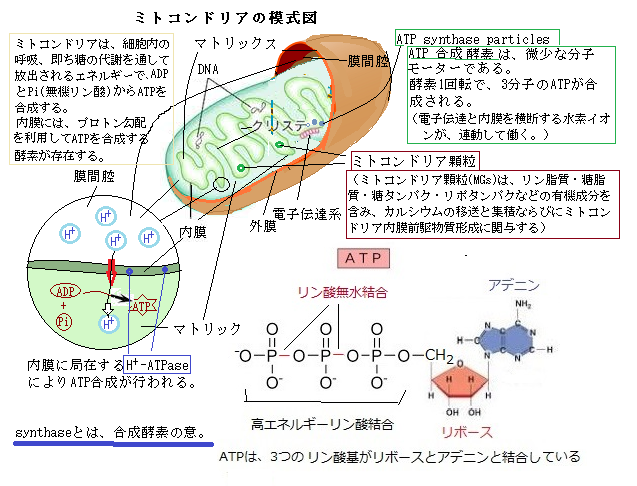 植物ミトコンドリアは、細胞呼吸や各種代謝を行う必須の細胞内小器官であり、細胞内に数百~数万個も存在する。
植物ミトコンドリアは、細胞呼吸や各種代謝を行う必須の細胞内小器官であり、細胞内に数百~数万個も存在する。植物ミトコンドリアは、各自が細胞内で活発に動きまわるダイナミックな存在である。
ミトコンドリアには、著しく長く、また網状につながったものや、細胞内で偏在するものや,、ミトコンドリア同士が凝集するものなど、ミトコンドリアの形状は不揃いで、しかも、それぞれが単離している。それでも、ミトコンドリアを細胞内に均一に配置し、大きさをある一定範囲内に調節する仕組みなどを司る遺伝子の存在がうかがわれる。
そして二次に及ぶ細胞内共生により生まれたのが植物細胞で、既にミトコンドリアを内包していた細胞が、光合成を行うシアノバクテリア(藍藻類)を取り込んだのだ。その後の進化によりシアノバクテリアを色素体という高精度な小器官にまで発達させた。
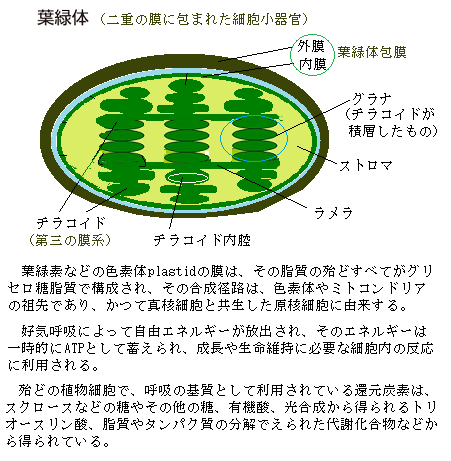 それを証明するのが、ミトコンドリアや色素体は、いずれも外膜と内膜の二重膜で囲まれていること、つまり、原始的な好気的細菌細胞や光合成細菌細胞が、宿主の原核細胞の膜内に陥入される当時のままに、新生の細胞小器官を囲む二重の膜として現在も残存していることである。
それを証明するのが、ミトコンドリアや色素体は、いずれも外膜と内膜の二重膜で囲まれていること、つまり、原始的な好気的細菌細胞や光合成細菌細胞が、宿主の原核細胞の膜内に陥入される当時のままに、新生の細胞小器官を囲む二重の膜として現在も残存していることである。また、ミトコンドリアや色素体の細胞小器官のゲノムが、原核生物のゲノムと配列が似ていることと、そのいずれのゲノムも核膜がなく、そのため核膜に包まれていないゲノムDNAと言う意味で核様体nucleoidと呼ばれていることからも推測される。
ミトコンドリア形態は、融合と分裂のバランスによって維持されている。融合・分裂のバランスが取れている場合は、俵型ミトコンドリアとなり、分裂ができなくなると融合のみが進むため長いミトコンドリアが生じる。一方で融合ができなくなると分裂のみが進み、細切れのミトコンドリアが生じる。
独自のゲノムを持つ植物ミトコンドリアゲノムは、動物や酵母のものと比較して数倍~100倍以上の大きさがある。また、植物ミトコンドリアゲノムには、 多様な大きさのDNAが混在する。
ところが、植物ミトコンドリアのDNAを、一つ一つ検定したところ、ミトコンドリアの多くは、DNAを1ゲノム分も持ったないか、DNAを殆ど持っていないようなものも多かった。それでも、多くのミトコンドリアは、ゲノム情報の足りない状態で存在しながらも、十分な機能を果たしている。
つまり、その状態のミトコンドリアは、ミトコンドリア同士の融合によって遺伝子情報を共有することで機能を獲得している考えられる。植物ミトコンドリアゲノムの存在様式は、一見、未完成ように見えるが、実際には、必須の遺伝子セットを揃え保持して、細胞分裂し、生育し、かつ不足なく次世代に引き継がれている。残念ながら、現段階では、これらの分子構造自体、未だ殆ど解明されていない。
そのため、植物ミトコンドリアゲノムは、現在、人為改変が不可能な状況のままである。
植物ミトコンドリアのゲノムサイズは、近縁の植物種と比較しても、180~11,000キロ塩基対(kbp;核酸を構成する塩基のうちの2個が、水素結合によって特異的に結合したもの。kbpはキロベースkilo base pairと読む。2個の塩基対を1bpと表記する。500個の塩基が並んだ核酸鎖(DNA鎖)は500bp、あるいは1k=1,000なので0.5kbp、1,000kpbは1M(mega)=1,000kなので1Mbpとなる。)と大きな較差があり、それほど異なっていると言える。
哺乳類のミトコンドリアのゲノムは、小型で均一な16キロ塩基対のサイズである。植物のミトコンドリアのゲノムの方が、はるかに大きい。そのサイズの違いは、植物のミトコンドリアDNA(mitochondrial DNA;mtDNA )には、多くのイントロンを含む非コードDNAが含まれているからである。シロイヌナズナのmtDNAは、35個のタンパク質をコードしているが、哺乳類のタンパク質は、13個のタンパク質しかコードしていない。しかし、核にあるいくつかのtRNA遺伝子は、ミトコンドリアのtRNAをセットとして揃えるのに不可欠な存在となっている。
mtDNAにコードされたタンパク質を除いた、おそらく2,000.以上のミトコンドリアのタンパク質、例えばクエン酸回路で関わるタンパク質などは、核DNAにコードされている。核にコードされるミトコンドリアタンパク質は、サイトゾルのリボソームで合成され、ミトコンドリアの外膜と内膜にある膜輸送体を介してミトコンドリアに輸送される。酸化的リン酸化には、つまり2つのゲノムに存在する遺伝子の発現に依存し、呼吸に関わる複合体を合成する時は、両者が協調しなければならない。しかしながら、呼吸に関わる複合体の形成には、核にコードされたサブユニットの発現の変化によって制御されるが、ミトコンドリアゲノムとの協調は、主に翻訳後に起こる。
ミトコンドリアタンパク質をコードする核遺伝子は、他の核遺伝子と同様に制御されているが、ミトコンドリア遺伝子の発現に関する詳細は、余り解明されていない。ただ、ミトコンドリアゲノムの役割は、特に花粉の形成には重要で、自然界で起こるmtDNA遺伝子の再編成により、植物体に細胞質雄性不稔cytoplasmic male sterility(CMS)を生じさせる。
この特性により、植物体にまでは、影響は及ぼさないものの、未成熟の段階で、プログラム細胞死programmed cell deathを誘導し花粉の発達を阻害している。このCMSの働きは、数種類の穀物の育種で、ハイブリッド種子のストックを作る時に利用されている。
ハイブリッド種子とは、異なる特性をもつ近交系または純系の品種を交配した一代雑種(F1)の種子で、雑種強勢を利用し、両親の素質をはるかに超えた品種を作り出す。その優れた遺伝特性は一代限りのもので、F1品種から種子を採り出しても、メンデルの遺伝法則に従い、雑種であるF1品種の子どもたちは、親とは、色・形・味・収穫時期などが異なり形質が一定しなくなる。
機能的な花粉を形成できない雄性不稔は、多くの植物種に見られ、それは自家受粉を回避するのに有効であるためである。雄性不稔は、ミトコンドリアゲノムに生じた、ある遺伝子の機能が増強される機能獲得型変異に起因して、母性遺伝するものが多いことから、細胞質雄性不稔と呼ばれる。CMSを、育種計画に利用するため、様々な作物の研究分野で広く行なわれている。
ミトコンドリアや色素体のゲノムDNAは、通常の核DNAのように、1つの環状分子になっていない、殆どの場合、直鎖状分子であり、時にはゲノム1コピー相当以上のDNAが、タンデムtandem(反復配列)に繋がった構造になっていることがある。
また、DNA分子が、樹木に茂る枝のように頻繁に枝分かれしている構造が観察されている。それは、複製過程にある細胞核DNA分子の構造に似ている。
核の染色体は、世代を重ねても大きさは変わらないが、ミトコンドリアや色素体の染色体DNAサイズは、組織や細胞の発展段階で変わる様子が見られている。しかも各細胞それぞれでは、ミトコンドリアや色素体が1コピーに満たない断片しかないばかりか、DNAの殆どか、全くない細胞が観察されている。各細胞にあるミトコンドリアや色素体のすべてが、完全なゲノムDNAを備えているとは言えない。
目次へ
CMS変異の多くは、ミトコンドリアのゲノム再編成によって生じた、新たな機能を持つキメラ遺伝子(2つの違った遺伝子、または2つの違った遺伝子の一部が融合した遺伝子をキメラ遺伝子と言う。植物の場合、遺伝型の異なる2個体間の接ぎ木で生じることがある。)によって引き起こされる。植物のミトコンドリアゲノムは大きいうえに、様々なサイズがあり、しかも特定領域で組み換わりやすい。
ミトコンドリアゲノムが再編成されると、2つの別個の配列が融合することで、ときおり新規の機能を持つ遺伝子が生まれる。今のところ同一変異であると同定されたCMS変異は見つかっていないが、どの新規遺伝子でも、葯で発現されるミトコンドリアの機能を阻害し、その結果、活性酸素種を産出してプログラム細胞死を引き起こすことが分かっている。
花の形態とCMSによる雄性不稔によって他殖が促進される種もいくつかあるが、大多数の雌雄同花種では、自家不和合性self-incompatibility(SI)と呼ばれる自己―非自己の認識機構によって厳密に他殖となる。
被子植物の進化の過程で、自家不和合性機構は複数回、それぞれ独立して登場して、様々な仕組みを生み出してきた。自家不和合性では、同種の他個体との受粉は許しつつも、自家受粉を避けるような生化学的な障壁を作るのである。
自己と非自己を判別できる能力は、多細胞生物種と微生物種の両方に広く見られる必須の機能である。たとえば脊椎動物では、非自己の認識を担う主要組織適合抗原major histocompatibility complex(MHC;histoは組織の意)の対立遺伝子が可変性(多型成)を持つことで、自己―非自己の識別が促進される。植物の有性生殖過程における自己―非自己の認識では、自家不和合性を担うS遺伝子座の働きで自己の花粉を認識し拒絶する。
遺伝子座locusとは、ある特定の形質に関する遺伝情報が存在する染色体の部位を言う。
遺伝子座にある遺伝子は、父親と母親それぞれから遺伝情報を引き継ぐため、異なる遺伝情報を持つことになる。 このとき相同の遺伝子座にあって、異なる遺伝情報を有する遺伝子を対立遺伝子allele(əlɛ́li)と呼び、ヒトなどの2倍体の生物では、それぞれの遺伝子座に、2つの対立遺伝子を持つことになる。
転座translocationとは、遺伝的物質の配列が変化することで、染色体断片の位置が変化する。最も一般的な転座の形は相互に起こり、2つの非相同の染色体の間で染色体断片を交換する。
染色体の断片が、相互に交換されることなく、同じ染色体、もしくは異なる染色体へ一方向的に移動する場合には、この種の転座は転位transpositionとも呼ばれる。染色体異常の1つで染色体の一部が切断され、他に付着するなどして、位置が変わることで突然変異の原因となる。
S遺伝子座には、複数の決定因子determinantとなる遺伝子群が含まれ、これらは雄組織である葯や花粉粒、または雌組織である雌ずいのどちらかで発現する。
被子植物の多くは、昆虫などが媒介する花粉を、自己の花粉とは受精しないよう「自家不和合性」という特性を、激変する環境変化を辛うじて凌ぐ手段として、それを進化の要としてきた。自殖を回避し、種の遺伝的多様性に期待を懸けて、環境ストレスに適応する種を、偶発性を重ねることで、絶えず形成し続けてきた。しかし、植物がどの様にして自己と非自己の花粉を識別しているのか、その仕組みは長年の謎であった。1920年代に始まった遺伝学的解析により、一つの遺伝子座、それがS遺伝子座であり、そのDNA配列パターン(Sハプロタイプ:S1, S2, ---, Sn)の異同を利用して、自己と非自己を識別していることが解明された。
花粉と雌しべが、同じSハプロタイプhaplotypeを持つ場合に「自己」、異なるSハプロタイプを持つ場合に「非自己」と判断している。そのSハプロタイプが、S遺伝子座を構成する遺伝子群であって、しかも単一の分離単位となって遺伝する。
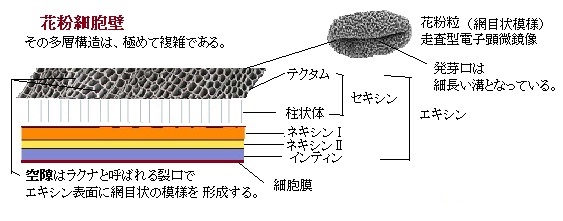
胞子体型自家不和合性sporophytic self-incompatibility(SSI)は、今のところアブラナ科植物だけであるが、その詳細が解明されている。アブラナ科では、S遺伝子座にある多様性に富んだ2つの遺伝子が、自家不和合性反応に関与している。花粉のS決定因子は、花粉外被に局在するシステインcystine(含硫 α-アミノ酸の一種。水素化された硫黄を末端に持つ極性分子SH 基で、多くの生体反応に関与する 。)に富むタンパク質で、S-locus cysteine-rich protein(SCR;SP11とも呼ばれている)と呼ばれる。硫黄は、生物が最も多方面で活用する元素である。
それぞれの花粉粒が持つS遺伝子座に、コードされたシステインに富むタンパク質(SCR)リガンドligand(主にタンパク質と特異的に結合する低分子量の分子。細胞膜の受容体に結合するホルモン・抗体などもリガンドと言う。)は、花粉細胞壁に局在し、花粉粒が柱頭に付くと柱頭表面に移動する。
SCRは、二倍体のタペート組織と半数体の花粉粒の両方で発現するが、タペート組織で作られたSCRのみが自家不和合性反応に必要である。この解析からアブラナ科の自家不和合性は、胞子体型であることが明らかになった。
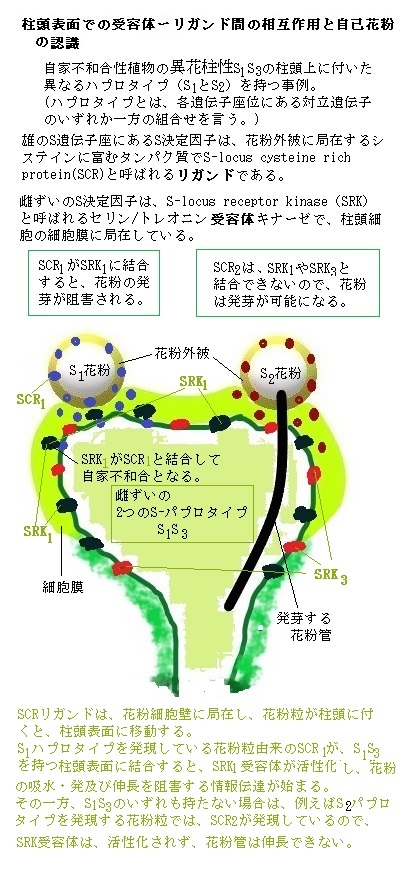
雌ずいのS決定因子は、S-locus receptor kinase(SRK)と呼ばれるセリン/トレオニン受容体キナーゼで、柱頭細胞の細胞膜に局在している。SRKは、自己の認識に関与している。しかも、SCRとSRKの両者をセットで、コードする特殊な遺伝子座であることも明らかになった。 SCRとSRKは、Sハプロタイプ毎に異なる配列を持つこと、同一Sハプロタイプ(=自己)のSCRとSRKが特異的に相互作用することで、自家受粉を認識していることが明らかとなった。SRKは、自己認識に関わり、その細胞外領域は、異なるその胞子体と異なるSパプロンタイプで変化に富んでいる。
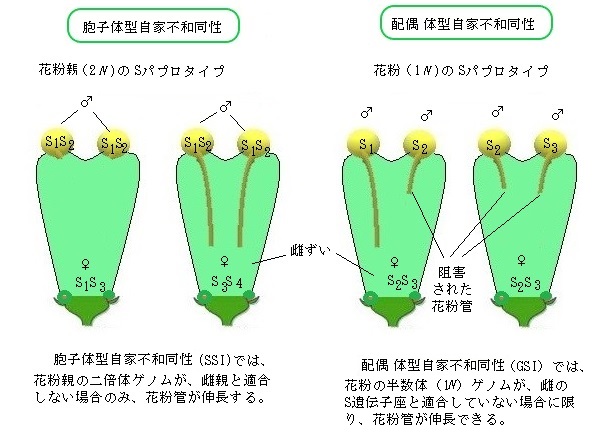 例えば、受精時に、S1ハプロタイプを持つ花粉が、S1ハプロタイプを持つ雌ずいに受粉すると、花粉因子(S1-SP11)により雌ずい因子(S1-SRK)が活性化(自己リン酸化)されて不和合性反応が起き、花粉の発芽・伸長が阻害される。
例えば、受精時に、S1ハプロタイプを持つ花粉が、S1ハプロタイプを持つ雌ずいに受粉すると、花粉因子(S1-SP11)により雌ずい因子(S1-SRK)が活性化(自己リン酸化)されて不和合性反応が起き、花粉の発芽・伸長が阻害される。
また、ナス科・バラ科の植物では、雌ずい因子はアブラナ科植物がもつ受容体型タンパク質SRKではなく、RNA分解酵素のS-RNaseであった。
S-RNaseが、自己の花粉管のRNAを分解してしまう細胞毒として機能することが分かっていたが、花粉因子とまでは理解されていなかった。
S遺伝子座上に多数のF-ボックスタンパク質(F-box protein)という、S-RNaseを無毒化するタンパク質群(SLF)がコードされていること分かり、これらが、実は、花粉因子であった。
F-ボックスタンパク質のように、シグナル伝達経路の構造や性質は、極めて多様であるが、そのすべての伝達径路に共通した特徴は、最初の刺激が受容体に受容されると、中間的プロセスを経てから、生理的応答をする部位に伝達されることにある。その受容体は、通常、内膜系も含む細胞膜やサイトゾルと核などに存在する。ホルモンや接触刺激受容体がよい例である。その刺激は、発生プログラムや外界の環境により生じる。応答メカニズムが至適に達した時、多くの植物受容体は、細胞内を移動して機能する。
真核細胞のE3ユビキチンリガーゼ複合体は、サイトゾルと核に存在し、分解の標的となる基質タンパク質に、共有結合によりユビキチンubiquitinを付加する。ユビキチン化されたタンパク質は、265プロテアソームproteasomeと呼ばれる巨大なタンパク質複合体が、このようなタッグ付き分子を特異的に認識し分解する。
SCF複合体(Skp,Cullin,F-box protein)は、E3ユビキチン‐タンパク質リガーゼで最大のサブファミリーで、さまざまな調節タンパク質、情報伝達系タンパク質のユビキチン化に関わっている。そのサブファミリーでは、F-ボックスタンパク質が基質認識の役割を担う。
リガーゼligaseとは、ATPなどの加水分解エネルギーを利用して、2つの基質の結合を触媒する合成酵素を言う。キナーゼkinaseは、リン酸化を触媒する酵素で、タンパク質などの基質にATPに由来するリン酸を付加するすることにより、その性質を変化させる。あるタンパク質が受容体の機能を備え、シグナルを受容すると「シグナルを受容した」ことを、他の分子をリン酸化することにより、その他の分子に伝達する時、そのタンパク質を受容体キナーゼreceptor kinaseと呼ぶ。
F-box 領域は、約60アミ ノ酸のタンパク質ドメインprotein domainsである。タンパク質ドメインは、タンパク質の配列、構造の一部で、他の部分とは独立に進化し、機能を持った存在である。それぞれのドメインは、独立に折り畳まれたコンパクトな三次元構造を作り、安定化されることが多い。F-ボックスタンパク質は、酵母を含めて、動物や植 物を問わず、菌類など多くの生物種で見いだされている。植物ゲノム上には、約300以上の F-ボックス タンパク質遺伝子が存在する。シロ イヌナズナでは694、イネで687遺伝子、ポプラで337遺伝子と、植物は総じて多い。動物では、ショウジョウバエで22遺伝子、ヒトで38遺伝子と動物と植物では、大きな隔たりがある。植物では、付加的あるいは改変されたコンポーネントを持つ場合が多いためである。これにより、植物のF-ボックスタンパク質の遺伝子ファミリーが、機能的に大きく多様化したため、活動の場が各段に広がったと言える。
各雌ずい因子に連鎖した多数のSLFは、分担して自己とは異なるS-RNaseと結合し、それを解毒することで他家受粉時の花粉管の伸長を可能にしていた。
例えば、S1ハプロタイプの花粉は、S1-SLF1, S1-SLF2, ---など多数の花粉因子を持つが、これが非自己の雌ずいに受粉すると、そこに存在する非自己の雌ずい因子のS2-RNaseやS3-RNaseなどは、この多数の花粉因子のいずれかによって認識され無毒化されるので、花粉管はRNAを分解されることなく伸長を続け、無事に受精するようになる。
受粉した際、決定因子の対立遺伝子群にコードされ、花粉側で発現するタンパク質の組み合わせによって、花粉が柱頭により自己と認識されるか、非自己と認識されるかが決定される。花粉粒と柱頭の細胞が、同じSハプロタイプの対立遺伝子を持つ場合、不和合性反応が起こり、花粉は拒絶される。
一方、花粉と柱頭がSハプロタイプの異なる対立遺伝子を持っていれば、受粉と受精の進行が可能になる。
植物の自家不和合性機構は、花粉粒の自家不和合性の表現型により、胞子体型自家不和合性と配偶体型自家不和合性の2つに大きく分けられる。
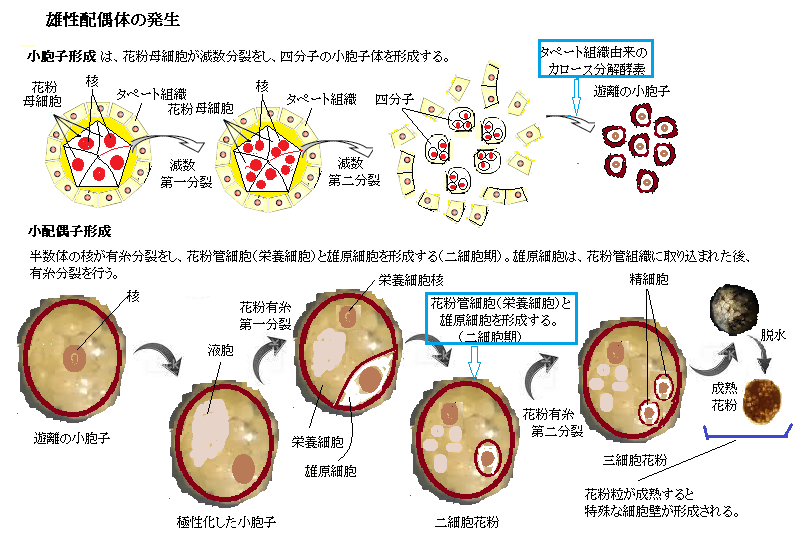 胞子体型自家不和合性sporophytic self-incompatibility(SSI)では、花粉粒が適合するか否かは花粉の親組織、より具体的には、葯を形成するタペート組織tapetumの二倍体ゲノムによって決まる。
胞子体型自家不和合性sporophytic self-incompatibility(SSI)では、花粉粒が適合するか否かは花粉の親組織、より具体的には、葯を形成するタペート組織tapetumの二倍体ゲノムによって決まる。小胞子形成を通じて、二倍体であるタペート組織は、それぞれのSハプロタイプから作られる2つの型のSCRをはじめとした様々なタンパク質を放出し、それらは花粉粒の細胞壁のエキシン層に取り込まれる。受粉すると、SCR(雄のS決定因子)は柱頭表面にに拡散し、乳頭細胞の細胞壁を通過して細胞膜へ到達する。
柱頭は二倍体であるため、乳頭細胞の細胞膜上には、それぞれのSハプロタイプに対応した2つの型のSRK(雌のS決定因子)が存在する。SRKは、それぞれS遺伝子座の同じハプロタイプに由来するSCRだけを認識して結合する。その結合により、SRKに自己リン酸化が起こる。このリン酸化が、一連の情報伝達の始まりで、通常であれば受粉した花粉が、柱頭で吸水し発芽する過程が、直ちに阻害される。
この胞子体型自家不和合性は、花粉外被にSCR型として現れている2つのSハプロタイプの内のどちらか一方だけでも柱頭に存在していれば引き起こされる。
 もし花粉の親組織が持っている2つのハプロタイプの一方が、雌ずいの2つのパプロタイプのいずれかと一致すれば、花粉は拒絶される。SSIによる不和合性反応では、一般的に、花粉が吸水・発芽する前の段階で花粉を拒絶する。そのSSIによって発芽しなかった花粉を、実験的に不和合の雌ずいから和合の雌ずいに移せば、発芽は可能になる。
もし花粉の親組織が持っている2つのハプロタイプの一方が、雌ずいの2つのパプロタイプのいずれかと一致すれば、花粉は拒絶される。SSIによる不和合性反応では、一般的に、花粉が吸水・発芽する前の段階で花粉を拒絶する。そのSSIによって発芽しなかった花粉を、実験的に不和合の雌ずいから和合の雌ずいに移せば、発芽は可能になる。自家不和合性は、被子植物にみられる自家受精を防ぐ機構である。多くの場合、自家不和合性は、多様性に富む多数のハプロタイプからなる一つの遺伝子座、即ちS遺伝子座に制御される。S遺伝子座には、雌性と雄性のSハプロタイプ特異性決定因子がコードされており、これらの因子によって受精が決定される。ナス科やバラ科などでは、雌性と雄性Sハプロタイプ特異性決定因子は、それぞれ単一のRNA分解酵素やS-RNaseと複数のF-ボックスタンパク質やSLF(花粉で発現するFボックスタンパク質をコードする遺伝子)である。
自家受粉された花粉管では、自己のS-RNaseによってRNAが分解し、花粉管が伸長を停止する。一方、他家受粉された花粉管では、複数のSLFが協調して、すべての非自己S-RNaseを認識し、ユビキチンubiquitin化を介した分解により、花粉管は伸長して受精に向かう。
 タンパク質はいったん合成されると、細胞内で数分から数時間、あるいは数日と言った限られた寿命であるため、定常状態における細胞内のタンパク質の蓄積レベルは、その合成と分解を反映しており、通常、タンパク質やRNAに適用される合成速度と分解速度のバランスを、ターンオーバーturnoverと呼ぶ。ターンオーバーで言う代謝回転の増加は、分解の増加について言うことが多い。
タンパク質はいったん合成されると、細胞内で数分から数時間、あるいは数日と言った限られた寿命であるため、定常状態における細胞内のタンパク質の蓄積レベルは、その合成と分解を反映しており、通常、タンパク質やRNAに適用される合成速度と分解速度のバランスを、ターンオーバーturnoverと呼ぶ。ターンオーバーで言う代謝回転の増加は、分解の増加について言うことが多い。植物と動物の両方の細胞には、タンパク質のターンオーバー径路が2つ存在する。1つは、特殊化した分解液胞(動物細胞ではリソソームlysosomeと言う)におけるものと、もう1つが細胞質におけるものとがある。
動物の細胞内に取り込まれた細胞外の粒子や分子の多くは、最後にリソソームに送られる。膜で囲まれた袋状のリソソームには、タンパク質・核酸・オリゴ糖・脂質などを分解する40種類ほどの加水分解酵素があり、細胞外から取り込まれた物質や老化した細胞小器官の細胞内消化を、調節しながら進めていく。
タンパク質のターンオーバーの細胞質における径路では、分解されるべきタンパク質に、ユビキチンと呼ばれる小さなタンパク質を構成する小さなポリペプチドを、ATPに依存して共有結合させ、標識されるようにする。
このような「ポリユビキチン化」は、分解の標的となるタンパク質のマーカーとなり、26Sプロテアソームproteasomeと呼ばれる巨大なタンパク質複合体は、このようなタッグ付き分子を特異的に認識し分解する。真核細胞における短命のタンパク質の90%以上は、ユビキチン径路で分解される。
S-RNaseは、雌しべで特異的に発現し、自己・非自己に関わらず花柱内を伸長中の花粉管に取り込まれることが、免疫電子顕微鏡観察によって明らかになっている。さらに、花粉の受粉後、雌しべ内の花粉管由来のRNAは、自己花粉管内では分解されるため伸長が阻害されるが、非自己花粉管内では、RNAは分解されず伸長する様子が観察されている。
S-RNaseは、約200アミノ酸からなる塩基性タンパク質であり、T2型RNaseスーパーファミリーに属するRNA分解酵素である。この酵素の活性部位に必要なファミリーの酵素には、RNase活性に必須な、アミノ酸残基である二つのヒスチジン残基histidine residueがあり、S-RNase周辺にそのアミノ酸配列がよく保存されている。このRNA分解活性に必須なヒスチジン残基を置換したS-RNase遺伝子を導入した植物の解析から、S-RNaseによるRNA分解活性が、自己花粉の拒絶に必須であることが判明している。
これらのことから、何らかの自他識別反応が、S-RNaseによる自己花粉管内のRNA分解のみを誘起していることが考えられる。
バラ科の自家不和合性を示す植物、梅Prunus mumeを用いて、雄性S決定因子をコードする遺伝子が、S-RNase遺伝子の下流域で、花粉で発現するF-ボックスタンパク質をコードする遺伝子が見つかった。これを、S-locus F-box(SLF or SFB)と名付けた。SLFは、S-RNaseと同様に多型性を示した。
前後して、オオバコ科植物のキンギョソウ野生種や、バラ科植物アーモンド、セイヨウミザクラ(果樹のサクランボの多くの品種がこの種に由来する)、スミミザクラ(ヨーロッパや南西アジアに自生するバラ科サクラ属サクラ亜属)からもSLFが見いだされた。
S-RNaseによる花粉管のSハプロタイプの特異的な排除を説明するためタンパク質分解モデルが提唱されてきた。このモデルでは、SLFが自己以外のすべての非自己のS-RNaseを認識し、ユビキチン-プロテアソーム系を介してこれを分解し解毒することを予想した。2つの対立遺伝子をもつ花粉から生じる2つの異なるSLFは互いに認識特異性を補完し合うことによって、すべてのS-RNaseを分解することが可能となり、花粉管はすべてのSハプロタイプの花柱で和合性になる。
多型性の低いSLF対立遺伝子により、極めて多様な非自己のS-RNaseを識別する仕組みについて、初めて明確な説明が成り立った。オオバコ科やバラ科の自家不和合性を示す種も、単一のS-RNaseの遺伝子と、複数のSLF様のF-ボックスタンパク質の遺伝子を、S遺伝子座に持つことが示されている。例えば、バラ科のリンゴでは12個のSLF様のF-ボックスタンパク質の遺伝子がS遺伝子座に連鎖している。
複数のタイプのSLF遺伝子がどのように出現し、単一のS-RNase遺伝子とともにどのように進化してきたのか、また、どのようにしてそれぞれのタイプのSLFが一部の非自己のS-RNaseを分子レベルで認識しているのか、さらには,SLFにより認識された非自己のS-RNaseはどのようにして無毒化されているのか、今後、明らかになるようだ。
配偶体型自家不和合性gametophytic self-incompatibility(GSI)では、花粉が適合するか否かは、花粉自体の半数体ゲノムによって決まる。この場合、花粉粒が持つ単一のS-パプロタイプが雌ずいの2つのS-パプロタイプのどちらかと一致すると拒絶される。SSIとは異なり、GSIによる不和合反応では、一般的には、花粉管の伸長は花柱の途中まで進んだ後に止まり、花粉管は機能を失うことが分かってきた。また、SSIは乾性型の柱頭で見られることが多く、このため、SSI花粉は、花粉管が発芽する前に、柱頭から吸水する必要がある。一方、GSIは湿性型の柱頭に多い。そのため、柱頭に付いた直後に吸水して代謝が活性化するため、急速に発芽がしやすくなる。
目次へ
細胞毒性のあるS-RNase(ribonuclease;S-リボヌクレアーゼ)とF-ボックスタンパク質によって引き起こされる配偶体型自家不和合性(GSI)は、被子植物では、一般的な自家不和合性の様式である。F-ボックスタンパク質には、S-RNaseを無毒化するタンパク質群(SLF)がコードされている。各雌ずい因子に連鎖した多数のSLFは、分担して自己とは異なるS-RNaseと結合し、それを解毒することで他家受粉時の花粉管の伸長を可能にしていた。
植物では、F-ボックス遺伝子ファミリーは、数百の遺伝子を持つまで拡大しており、それと同じ数の標的タンパク質が、このファミリーにより分解されているようだ。これらのF-ボックスタンパク質には、ホルモン受容体複合体としても機能しており、それにより多くのホルモンシグナル伝達経路で分解されている標的タンパク質は、転写抑制因子である。
配偶体型自家不和合性(GSI)は、単一の複対立遺伝子座(S遺伝子座)によって制御されており、そこには強く連鎖した2つの遺伝子が含まれている。1つは花粉で発現する雄の決定因子であり、もう1つが雌ずいで発現する雌の決定因子である。
ナス科やゴマノハグサ科、バラ科では、花粉側の決定因子は、SLF/SFBと呼ばれるF-ボックスタンパク質であり、ユビキチン化径路を介した標的タンパク質の分解に関与している。
真核細胞のE3ユビキチン‐タンパク質リガーゼは、ATP依存的にユビキチンと呼ばれる小さなタンパク質が、ユビキチン活性酵素により活性化された状態で、サイトゾルと核に存在し、分解の標的となる基質タンパク質に、共有結合してユビキチンubiquitinを付加する。ユビキチン化されたタンパク質は、265プロテアソームproteasomeと呼ばれる巨大なタンパク質複合体が、このようなタッグ付き分子を特異的に認識し分解する。
SCF複合体(Skp,Cullin,F-box protein)は、E3ユビキチン‐タンパク質リガーゼで最大のサブファミリーで、さまざまな調節タンパク質、情報伝達系タンパク質のユビキチン化に関わっている。そのサブファミリーのF-ボックスタンパク質が、大きなタンパク質複合体のファミリーの一員を基質として認識し、ユビキチン化し、265プロテアソームの標的にして、タンパク質分解の引き金とする。
雌ずい側の決定因子は、細胞毒性を持つS-RNaseであり、花柱の伝達組織で特異的に発現している。半導体の花粉のS決定因子のハプロタイプと、二倍体の花柱が持つ2つのS決定因子の内の1つのハプロタイプが一致すれば、花粉管の拒絶反応が起こる。
GSIでは、雄の決定因子と雌の決定因子の相互作用について、その分子的基盤の殆どが明らかになっていない。ただ、雄の決定因子が、雌ずいのハプロタイプの対立遺伝子であるかどうかに関わらず、二倍体の花柱の伝達組織で作られた2つのS-RNaseが花粉管に取り込まれるという重要な発見がなされている。S-RNaseと花粉側のS決定因子との認識は、花粉管内部で起こるということで、そこで自己のS-RNaseだけが細胞毒性を示すのである。
この観察により、雄の決定因子SLF/SFBが、ユビキチン-26Sプロテアソーム依存的な径路を介するタンパク質に関与するE3リガーゼ複合体SCFの構成要素であるF-ボックスタンパク質として同定された。
以上のことから、自家受粉では、花粉管内で非自己のS-RNaseだけが、花粉管のSCFSLFによって認識され、ユビキチン化と分解が引き起こされる。それにより非自己のRNaseの毒性が無効化され、花粉管の伸長が継続される。しかし、自己の花粉であれば、伝達組織由来のS-RNaseが、SCFSLFと結合できず、結果的に有毒なS-RNaseは花粉管の栄養細胞のRNAを分解し、細胞死を引き起こす。
他家受粉では、二倍体の花柱の伝達組織で作られた後、花粉管に取り込まれ2つの非自己のS-RNaseが、花粉管のSCFSLF複合体によって認識され分解されるため、いずれのS-RNaseによる毒性が取り除かれて、花粉管は伸長できる。
上記の単純なモデルは、GSIのいくつかの特徴を示すが、すべてではない。植物は、防御化学物質を非毒性の水溶性糖抱合体として液胞中に蓄積する。例えば、S-RNaseを花粉管の液胞に隔離することが、S-RNaseの細胞毒性から細胞を守るのに重要であることが見出されていることから、不和合反応の際、液胞膜の崩壊が花粉管のプログラム細胞死の引き金となっているかもしれない。
目次へ