細胞化学 cytochemistry
| |||||||||||
 |
|||||||||||
| |||||||||||
| DNA DNAが遺伝物質 生物進化と光合成 葉緑素とATP 植物の葉の機能 植物の色素 葉緑体と光合成 花粉の形成と受精 ブドウ糖とデンプン 植物の運動力 光合成と光阻害 チラコイド反応 植物のエネルギー生産 ストロマ反応 植物の窒素化合物 屈性と傾性(偏差成長) タンパク質 遺伝子が作るタンパク質 遺伝子の発現(1) 遺伝子の発現(2) 遺伝子発現の仕組み リボソーム コルチゾール 生物個体の発生 染色体と遺伝 対立遺伝子と点変異 疾患とSNP 癌変異の集積 癌細胞の転移 大腸癌 細胞の生命化学 酸と塩基 細胞内の炭素化合物 細胞の中の単量体 糖(sugar) 糖の機能 脂肪酸 生物エネルギー 細胞内の巨大分子 化学結合エネルギー 植物の生活環 細胞のシグナル伝達 キク科植物 陸上植物の誕生 植物進化史 植物の水収支 拡散と浸透 細胞壁と膜の特性 種子植物 馴化と適応 水の吸収能力 稲・生命体 胞子体の発生 花粉の形成と構造 雌ずい群 花粉管の先端成長 自殖と他殖 フキノトウ アポミクシス 生物間相互作用 バラ科 ナシ属 蜜蜂 ブドウ科 イネ科植物 細胞化学 | |||||||||||
| 目次 | |||||||||||
| 1)ウイルスと呼ばれる病原体 | |||||||||||
| 2)植物ウイルス | |||||||||||
| 3)レトロウイルス | |||||||||||
| 4)トランスポゾン | |||||||||||
| 5)インフルエンザウイルス | |||||||||||
| 6)分子生物学「分子進化」 | |||||||||||
| 7)エピジェネティクスepigenetics | |||||||||||
| 8)ES細胞とiPS細胞 | |||||||||||
| 9)幹細胞と増殖性の前駆細胞 | |||||||||||
| 10)iPS細胞 | |||||||||||
| 11)DNAメチル化 | |||||||||||
| 12)リンパ球 | |||||||||||
| 13)エピジェネティックな修飾 | |||||||||||
1)ウイルスと呼ばれる病原体
すべての生物は、細胞からできている。それがまた、単独で生きられる基本単位となっている。細胞という共通の構造には、細胞が生きていくための共通の機能が働いている。
細胞に共通する構造を支える物質基盤は、遺伝子としてのDNA、それを機能化する高分子のタンパク質、その細胞全体を保護しながら働く膜構造としての脂質などの共通性が見られる。そうした細胞の基盤からエネルギー産生や代謝によって細胞としての恒常性を維持し、環境変化に応答しながら子孫(細胞や個体)の繁栄に繋げている。
これらが生物に共通する性質、即ち単一性unityである。地球上の殆どの生物は、生命活動の基本となる構成では共通の特徴を持っている。即ち、4つの塩基からなるDNAを持ち、タンパク質には共通の20種類のアミノ酸を使い、しかも、DNAに書かれた遺伝情報を元に、機能分子であるタンパク質を作る仕組みなど、多くは共通している。
更に、遺伝暗号も一部の例外を除けば基本的には同じである。要するに、地球上に現存する生物は一つの祖先生物の子孫であるか、少なくとも遺伝装置やタンパク質合成装置など生命活動に必須の遺伝子については同一のものを共有した一つの種から進化し、分化してきたと考える方が正鵠を得ている。これが生物の定義でもあれば、ウイルスvirusが、生物らしい細胞としての構造も機能を持たないため、生物には含めない理由となっている。
 しかしながら、ウイルスの生態は、生物の根源のような働きをしている。
しかしながら、ウイルスの生態は、生物の根源のような働きをしている。ウイルスもタンパク質の殻とその内部に入っている核酸からなる遺伝子を持っている。簡単な構造であるが、遺伝子の周りをタンパク質が包んでいる。一番外側のタンパク質は細胞に吸着する構造になっている。
ウイルスは、光学顕微鏡では見ることができず、電子顕微鏡でしか見ることができない。細菌濾過器を通過してしまう病原体で、生物と無生物の中間形とされ、大きさは20~300㎚と、細菌の50分の1程度と小さく、生命の最小単位である細胞にも満たない。つまり、ウイルスは、生物細胞の基本単位である、単独で生きられる自身の細胞を持たず、宿主生体内または細胞培地においてのみ自己複製することが可能であり、そこでゲノムを増殖させる。
ウイルスは、かつてどんな小さな細菌細胞も通さないフィルターすら通り抜けられる、極微細な病原体と分類されていた。
ウイルスは、外被タンパク質coat proteinに包まれ保護されるゲノムであり、植物や動物、細菌を含むすべての生物を宿主にすることができる。従って、ウイルスの上位の分類は、ゲノム核酸の性状によって決められる。つまり、ゲノム核酸がDNAであるかRNAであるか、それが1本鎖であるか2本鎖であるか、直接翻訳の鋳型となる+(プラス)鎖となるか、相補鎖が鋳型となる-(マイナス)鎖となるか、さらに単一のゲノム核酸からなるか、複数の分節したゲノムからなるか、などの基準で分類される。
他の細胞に入り込んで生き、自身の遺伝子を発現してタンパク質は作れるが、増殖するためには、他生物の生きた細胞に進入して、その分子装置を取り込んで、自己を複製させて増殖する、極微小な感染性の構造体なので、非生物とされる。
細胞構造をもたず、粒子状ないし膜状のcoat proteinと呼ばれるタンパク質複合体によって被覆されており、その内部に1本ないし2本鎖の核酸を遺伝情報としてもち、感染した宿主細胞側の核酸合成系・タンパク質合成系を利用して増殖する。
ウイルスが増殖するには、最初に、ウイルスゲノムだけが宿主細胞に侵入する必要がある。その細胞内でウイルスゲノムが多数複製されてDNAコピーが多数作られる。それらにより転写・翻訳されてウイルス外被タンパクも作られる。その結果、ウイルスゲノムとウイルス外被タンパクは、自発的に集合して新しいウイルス粒子が多数完成する。ウイルス粒子は宿主細胞を溶解して脱出し拡散する。多くの ウイルスは、初感染時に直ぐに溶解感染を遂行して子孫ウイ ルスを大量に産生することで生存確率を高めている。
ウイルスの感染の症状は、ウイルスの溶解作用によるものが多い。例えば、単純ヘルペスウイルスによる口唇ヘルペス(熱の華)も、同じヘルペスウイルス科の水痘帯状疱疹ウイルスによる水痘も、ヒトの皮膚細胞が局所的に溶解(固体・液体・気体などが分子の水準まで均一に分散している状態)して生じる。
ヘルペスウイルスの仲間に属するエプスタイン・バーウイルスEpstein-Barr virus (EBV)は、宿主由来の脂質二重層のウイルスエンベロープvirus envelope外膜を持つ二本鎖DNA(dsDNA)ウイルスである。エンベロープには、ウイルス特異的な糖タンパク 質が突き刺さっている。
地球上に最も多く存在するウイルスは、細菌に感染するdsDNAウイルスと考えられている。170kb(kilo base;DNAの塩基対 1,000 個を表す単位。遺伝子の大きさや染色体上の位置を表す際に用いられる)にも及ぶ長大なゲノムに80を超える遺伝子をコー ドしている。EBVは唾液を介して感染を広げる病原性ウイルスであり、主にB細胞に感染する。そのEBVの場合は、少なくとも一部はそれほど強力に自己複製を押し進めず、感染細胞では目立たないよう潜伏して免疫を逃れつつ、宿主細胞ごと複製してもらう葛藤のない維持拡大という巧妙な潜伏であるため、ウイルスは終生にわたって排除できない。
ウイルスタンパク質の殻の中に包み込まねる遺伝物質の量には限りがある。最も単純なウイルスでも、その複製に必要な多数の酵素やその他のタンパク質の遺伝子を収納するには、外被タンパク質coat proteinの殻は小さすぎるので、自身の増殖のためには、宿主の生化学装置を乗っ取らなければならない。ウイルスゲノムには、自身の外被タンパク質を形成す遺伝子と、自身の遺伝子物質の複製に必要な酵素を宿主から奪い取るのを助けるタンパク質の遺伝子が含まれている。
ヒトや動物・バクテリアにも感染し、そこで増殖し病気を起こす。ヒトの体にウイルスが侵入すると、ヒトの細胞の中に入って自分の多数のコピーで満たす。やがて細胞が破裂して多数のウイルスが飛び出し、ほかの細胞に入りこみ、同様にして、ウイルスは増殖していく。
複雑なウイルスになると、複数のタンパク質を含む外被タンパク質で覆われている。植物ウイルスは細胞間移行に必須な移行タンパク質を持っており、その移行タンパク質に加えてウイルス粒子を形成する外被タンパク質も、複数のウイルス属では細胞間移行にも関わっていることが知られている。ウイルス粒子の中には酵素を含んでいるものがあり、外被タンパク質は、遺伝子が分解されるのを防ぐだけでなく、宿主細胞表面の受容体に結合して、ウイルスが宿主細胞内に効率よく侵入できるようにしている。
ウイルスが増殖するためには、核酸やタンパク質を合成する機構が必要である。そのためには、エネルギーやヌクレオチド・アミノ酸の供給が伴わなければならない。ところがウイルスは、そういう材料を持ち合わせていない。また、このような反応を効率よく行なう場となるはずの細胞という構造になっていない。ウイルス自身、ウイロイドviroids(植物に感染する大きなRNAゲノム)と比較すれば構造は複雑で、他に細胞内に効率よく侵入し得ても、それ以外は単なる核酸分子と大してかわらないのである。
ウイルスは設計図としての遺伝子だけの存在で、その遺伝子による増殖反応をする機構を保有していないため生物と言えないのである。生物はすべて細胞からできている。すべての細胞は細胞膜に囲まれている。インフルエンザウイルスは、細胞膜をかぶっているが、細胞膜を持たないウイルスも多い。ただし、細胞膜を持ったからと言って、そのインフルエンザウイルスが生物の仲間入りができるわけでもない。
感染する生物に応じて植物ウイルス・動物ウイルス・細菌ウイルス(バクテリオファージ)があり、また、核酸の違いに応じて、DNAウイルスとRNAウイルスに分類することができる。
ヒトの病原ウイルスの多くは、二本鎖のDNA、または一本鎖のRNAでできたゲノムを持つ。ただ、一本鎖のDNAや二本鎖のRNAも存在する。
最も単純なウイルスは、一種類のポリペプチドチド鎖が多数集合して形成されたタンパク質外被に包まれ、3個の遺伝子からなる僅かなゲノムしか持たないものもあるが、複雑なウイルスになると、数百からなる遺伝子を持つゲノムの大きなものまである。後者には、様々なタンパク質からなる精巧な殻を備えている。
T4バクテリオファージbacteriophageのバクテリオファージとは、細菌を宿主として増殖する細菌ウイルスの通称で、単にファージともいう。Phageは、ギリシア語phagein「食べる」の意味で、DNAを頭部に持つ大型のウイルスで大腸菌に感染する。
T4バクテリオファージは、長くて収縮する円筒状の尾で細菌の細胞壁を突破して、細胞内にファージの核酸を送り込む。従って、ウイルス自身の細胞を持たず、宿主細胞内でのみゲノムを増殖させる。ファージが感染した細菌は、細胞膜を破壊される溶菌という現象を起こし、死細胞を残さない、宿主細菌がまるで食べ尽くされたかのように死滅する。
目次へ
ポテトウイルスX (potato virus X)は、RNAゲノムを持つ細くて長い管状の植物ウイルスである。世界中に広く分布するウイルスで、感染しても殆ど病徴が表れないため、多くの栽培ポテト品種が保有し、それにより最大で20%の収量が減少していると言う。経済的に非常に重大な被害となっている。アブラムシがそのウイルスを媒介する。感染したポテトの葉は、僅かな白化、表面の粗さ、縁のうねりなどの病徴が見られる程度である。
植物ウイルスの防除戦略の一つとして、抵抗性遺伝子を導入した耐性植物種が作出されている。植物ウイルスに対する抵抗性機構として、過敏感反応hypersensitive response(HR)が最も広く知られている。その後の、HRにおいては抵抗性遺伝子が、ウイルスのタンパク質を認識することによりウイルスの侵入を検知し、初期感染細胞を速やかにプログラム細胞死させるなどの様々な反応が引き起こし、ウイルスによる全身感染を阻止している。
 植物細胞は、病原体が侵入を開始すると間もなく原形質流動が停止する。続いて被侵入細胞が死亡すると、侵入した病原体も生育を停止しする。この過敏感反応に見られる急激な細胞死を「過敏感細胞死」と呼ぶ。過敏感細胞死に先立って、主に原形質膜に存在する、生物体内にあって酸化反応を触媒する酵素のオキシダーゼoxidaseに依存する、活性酸素種であるスーパーオキシドsuperoxideなどが生成される。活性酸素は、
宿主細胞と病原体の両方に細胞毒性を示すとともに、防御遺伝子の活性化のメッセンジャー(情報伝達物質)として機能する。過敏感細胞死は、感染を受けた局部の細胞が病原体を道連れに自発的に細胞死する。過敏感細胞死は、移動という危機回避手段をもっていない植物が体の一部を犠牲にすることで個体全体を護るという、進化の過程で獲得した防御である。
植物細胞は、病原体が侵入を開始すると間もなく原形質流動が停止する。続いて被侵入細胞が死亡すると、侵入した病原体も生育を停止しする。この過敏感反応に見られる急激な細胞死を「過敏感細胞死」と呼ぶ。過敏感細胞死に先立って、主に原形質膜に存在する、生物体内にあって酸化反応を触媒する酵素のオキシダーゼoxidaseに依存する、活性酸素種であるスーパーオキシドsuperoxideなどが生成される。活性酸素は、
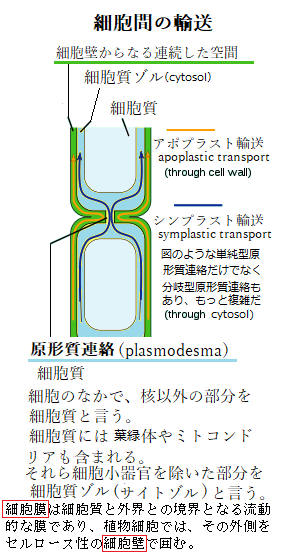
宿主細胞と病原体の両方に細胞毒性を示すとともに、防御遺伝子の活性化のメッセンジャー(情報伝達物質)として機能する。過敏感細胞死は、感染を受けた局部の細胞が病原体を道連れに自発的に細胞死する。過敏感細胞死は、移動という危機回避手段をもっていない植物が体の一部を犠牲にすることで個体全体を護るという、進化の過程で獲得した防御である。植物ウイルスの多くは、1本鎖RNAをゲノムに持ち、植物体表面についた傷や昆虫などの媒介生物により植物細胞に侵入する。ウイルスは、直ちに植物細胞の翻訳機構を利用して、ウイルスタンパク質を翻訳し、ウイルスゲノムの複製を開始する。宿主細胞で増殖したウイルスは、隣り合った植物細胞間の原形質連絡と呼ばれるプラズモデスムplasmodesmaと呼ばれるmicroscopic channelを介して隣の細胞に移行する。この植物ウイルスの複製と細胞間移行を繰り返すことで周囲の細胞へと拡がり、その後、維管束系へと侵入し植物体全身へと拡大する。植物ウイルスは、複製・細胞間移行・長距離移行と言う過程を経て、ウイルスゲノムにコードされた極めて少ない遺伝子を駆使し、植物細胞の代謝系に依存しながら、植物タンパク質を巧妙に利用して支配拡大する。
その際、植物の翻訳機構に関わるeEF1A遺伝子プロモーターが、ハウスキーピング遺伝子(多くの組織や細胞中に共通して常に一定量発現する遺伝子であるため、細胞の維持と増殖には不可欠な遺伝子である)として活性化し、宿主植物の複製酵素とウイルスゲノムRNAとを結合させていることが明らかになった。
DNAやRNAは、物質そのもので生物とは言い難い。しかし、裸のRNAそのものが植物に取り付いて、ウイルスのように、その細胞内で増殖し病気を起こす。この病原性のものは、低分子量の環状1本鎖RNAだけを本体とする病原体なので、ウイルスとまでは呼べず「ウイロイドviroid」と言う。その RNAは、最も小さいウイルス RNAの10分の1以下の大きさしかないが、その感染力はどの植物ウイルスよりもはるかに強い。
ウイロイドはウイルスよりもさらに単純な構造の病原体で、タンパク質の殻をもたない、300〜600塩基対の短い1本鎖の裸の RNAだけからなる。ウイロイドは、タンパク質を持たないだけでなく、そのゲノムRNAはタンパク質をコードしない、いわゆるnon-coding RNAである。そのためタンパク質合成系のないウイルスは、当然、タンパク質からなるrRNAやtRNAを持つことやこれらのRNAをコードする遺伝子を持つことはない。複製は宿主のDNA依存RNAポリメラーゼ(Polymeraseは、DNAやRNAのような核酸ポリマーや長鎖を合成する酵素)によって行われ、RNAの環状化には宿主DNAリガーゼ ligaseが用いられる。
 RNAウイルスは、突然変異が生じやすく、絶え間なくゲノム情報を変化させるため、自然界で活発に増殖する。ゲ ノム情報の変化は、それまでウイルスの免疫抗体の無力化と、薬効による予防治療効果の低下ばかりか、RNAウイルスの新興、あるいは再興による感染症の拡大が起こりやすい。
RNAウイルスは、突然変異が生じやすく、絶え間なくゲノム情報を変化させるため、自然界で活発に増殖する。ゲ ノム情報の変化は、それまでウイルスの免疫抗体の無力化と、薬効による予防治療効果の低下ばかりか、RNAウイルスの新興、あるいは再興による感染症の拡大が起こりやすい。ウイロイドは細胞間の原形質連絡を介して隣の細胞に移行し、篩管を通じて全身移行する。基本的にウイロイドは宿主植物に全身に感染するが、茎頂部や胚珠などの生殖器官など特定の器官への侵入に限定されていることが多い。茎頂部は花芽を形成し、やがて、胚珠や花粉を形成する元となる組織である。この部位への感染は、種子への伝播に波及する。感染茎頂部や胚珠などの重要組織への移行は、ウイロイドを後代へ残すことになる。
ただ、ウイロイドの伝染方法は、汁液接種や栄養繁殖(例えば、ジャガイモは塊茎による栄養繁殖によって増殖する)による伝染、及び種子伝染や花粉伝染である。一般的に昆虫媒介や土壌伝染はしないとされている。
虫媒伝染も土壌伝染もできないウイロイドにとって種子伝染できないことには、それで消滅するしかない。種子伝染はウイロイドにとって重要な生き残りの手段である。分裂組織や卵細胞、胚への侵入はウイロイドの重要な進化の到達点であった。種子伝染可能な塩基配列をもつウイロイドと、それを受け入れる宿主植物種の組み合わせが成立したことにより、ウイロイドによる病徴発現の程度が高まれば、宿主植物自体の種子形成に影響もするばかりか、ウイロイドの存在にも危険が及ぶ。つまり、発病によって感染植物が枯死または種子形成阻害を起こしてしまえば、ウイロイド自体も消滅する。発病程度が小さいほど、ウイロイドは感染植物の子孫へ伝播できるのである。
1971年に、最初のウイロイドとして同定されたPSTVd(Potato spindle tuber viroid)の感染のように、激しい病徴発現を示す植物種は、トマトやジャガイモくらいしかなく、殆どの宿主植物種では無病徴感染である。ウイロイドの生き残り戦略の一つが見えてくる。
RNAウイルスは、ジャガイモや柑橘類などの矮化を引き起こすものが多い。ホップ矮化病・リンゴ銹(さび)病・スモモ斑入り果病など 15種の植物ウイロイド病が発見されている。
目次へ
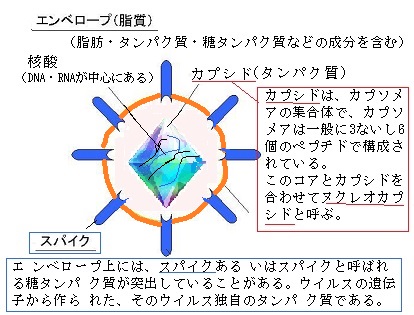
 レトロウイルスretrovirusも、RNAウイルスの1種であるが、レトロウイルスはRNAを遺伝子に持ち、逆転写酵素によって、RNAから2本鎖DNAを合成して、宿主細胞のDNAに組み込むことができる。レトロウイルスゲノムは、通常、7,000から12,000塩基のRNA分子からなる。これをタンパク質の外被が包み、更にその外側をウイルス遺伝子から作られるエンベロープタンパクを含んだ脂質のエンベロープが囲む。
レトロウイルスretrovirusも、RNAウイルスの1種であるが、レトロウイルスはRNAを遺伝子に持ち、逆転写酵素によって、RNAから2本鎖DNAを合成して、宿主細胞のDNAに組み込むことができる。レトロウイルスゲノムは、通常、7,000から12,000塩基のRNA分子からなる。これをタンパク質の外被が包み、更にその外側をウイルス遺伝子から作られるエンベロープタンパクを含んだ脂質のエンベロープが囲む。ウイルスは遺伝子である核酸を中心にして、その周囲をタンパク質の外殻であるカプシッド capsidで包んだ構造からできている。カプシッドはゲノムを包み、核酸分解酵素からゲノムを保護する。この構造をヌクレオカプシッドnucleocapsidという。ウイルスの複製に必要な遺伝情報は、ゲノムにコードされている。ウイルスのゲノムは、DNAかRNAどちらか一方の核酸が持つ。
ウイルスの種類によっては、ヌクレオカプシッドの外側に、さらに脂質と糖タンパクからなる被膜、エンベロープenvelopeを持つ。エンベロープ 内のタンパク質は、ウイルス自体の産物であるが、脂質は宿主細胞由来であり、エンベロープの脂質は宿主細胞の膜に類似する。即ち、エンベロープは、脂質二重層からなる膜で、ウイルスが感染した宿主細胞内で増殖し、そこから細胞外に出る際に細胞膜あるいは核膜などの生体膜を被膜したまま出芽することによって獲得されるものである。
エンベロープの獲得部位は、細胞膜・小胞体膜・ゴルジ体膜・核膜のいずれかで、ウイルスにより異なる。エンベロープは細胞内で作られたヌクレオカプシッドが、宿主細胞から出芽し、感染性を有する完全なウイルス粒子(ビリオンvirionと呼ぶ)に成熟し、形成される。エンベロープを有するウイルスは界面活性剤(石鹸など)やアルコールなどの脂質を溶かす消毒剤に対して感受性が高い。
インフルエンザウイルスは、エンベロープの脂質被膜を持つ。消毒用エタノールや手洗い石鹸は、脂質を壊す効果があるため、脂質膜であるエンベロープを破壊できる。エンベロープが壊れると、インフルエンザウイルスは活性を失い、感染力がなくなる。インフルエンザの感染対策として、「石鹸による手洗いが大切」という理由はここにある。
これに対し、手などを介して口から侵入し腸管に経口感染するノロウイルスには、エンベロープがない。タンパク質からなるカプシドという外殻でRNAを覆うため、胃酸や腸管の胆汁酸に溶解されず増殖する。
RNAとともに包み込まれた逆転写酵素も、レトロウイルスのゲノム内に遺伝子を持っており、レトロトランスポゾンと同様に逆転写酵素を使って、ウイルスRNA分子から一本鎖DNAコピーを作る。次にもう1つDNA鎖を作るので、ウイルスRNAゲノムから転写された二本鎖DNAができる。
 レトロウイルスの場合、数分子の逆転写酵素とRNAゲノムが一緒に、各ウイルス粒子に包まれたレトロウイルスの一本鎖RNAゲノムが、宿主細胞に侵入すると、ともに侵入した逆転写酵素が相補鎖DNAを合成し、DNA/RNAハイブリットの二重らせんができる。RNA鎖は除去され、逆転写酵素が相補鎖DNAを合成してDNA二重らせんが完成する。ウイルス遺伝子から作られた酵素インテグラーゼintegrase(ウイルスDNAを細胞染色体に組み込む酵素;「inte」は、ラテン語 inter が由来、inter は between、「間」を意、graseは「組み込む」)の働きで、このDNA二重らせんが宿主染色体に、部位を選ぶことなく組み込まれる。
レトロウイルスの場合、数分子の逆転写酵素とRNAゲノムが一緒に、各ウイルス粒子に包まれたレトロウイルスの一本鎖RNAゲノムが、宿主細胞に侵入すると、ともに侵入した逆転写酵素が相補鎖DNAを合成し、DNA/RNAハイブリットの二重らせんができる。RNA鎖は除去され、逆転写酵素が相補鎖DNAを合成してDNA二重らせんが完成する。ウイルス遺伝子から作られた酵素インテグラーゼintegrase(ウイルスDNAを細胞染色体に組み込む酵素;「inte」は、ラテン語 inter が由来、inter は between、「間」を意、graseは「組み込む」)の働きで、このDNA二重らせんが宿主染色体に、部位を選ぶことなく組み込まれる。 インテグラーゼは、ウイルスDNAがヒトの細胞のDNAに入り込む際に、ヒトのDNAを切り開き、その間にウイルスDNAを組み込ませる働きをする。この組み込みにより、ウイルスは潜伏し、新しいウイルスRNA分子が、宿主細胞のRNAポリメラーゼpolymerase(polymeとは重合体、raseとは解体する意、生物学上の発見当時の研究レベルに起因する呼びなか?)によって合成される。
インテグラーゼは、ウイルスDNAがヒトの細胞のDNAに入り込む際に、ヒトのDNAを切り開き、その間にウイルスDNAを組み込ませる働きをする。この組み込みにより、ウイルスは潜伏し、新しいウイルスRNA分子が、宿主細胞のRNAポリメラーゼpolymerase(polymeとは重合体、raseとは解体する意、生物学上の発見当時の研究レベルに起因する呼びなか?)によって合成される。タンパク質のコードは遺伝子DNAに存在するため、遺伝子DNAに書かれたタンパク質の情報はいったんmRNAに転写された後に、細胞小器官のリボソームの酵素作用によって隣り合ったアミノ酸がペプチド結合をしてタンパク質となる。ここでDNAからmRNAへの転写を行うのがRNAポリメラーゼである。RNAポリメラーゼは、遺伝子DNAを鋳型に、RNAの素となる4つA:アデノシン・ U:ウリジン・ G:グアノシン・C:シチジンなどの塩基とリボースribose=五炭糖を重合しヌクレオシドを合成する。
宿主細胞が分裂するたびに、宿主細胞のDNAに組み込まれたウイルスゲノム(プロウイルスprovirus)のコピーが子孫細胞へ伝えられる。こうして、レトロウイルスは宿主細胞のDNAに組み込まれる。プロウイルスとは、レトロウイルスのRNAゲノムが逆転写酵素によりDNAに変換された後、インテグラーゼによって、細胞のゲノムDNAに組込まれる。その状態にあるウイルスの遺伝子を「プロウイルス」と呼ぶ。この組み込まれたプロウイルスが、発がんウイルスのほか、エイズウイルスになる。
「レトロretro」という接頭語は、「戻って」・「逆に」・「遡って」などの意味で、レトロウイルスでは、DNAからRNAへという通常の情報の流れが逆流することを意味する。
レトロウイルスの起源を遥かに遡れば、ウイルス粒子が突然変異を繰り返しながら、形態形成を重ねる度に、自己の固有種を守るために、必要な外被タンパクなど諸々のタンパク質を獲得したレトロトランスポゾンretrotransposonによる進化の到達点と思える。その後に複製サイクルを担うRNAが形成されと、ウイルス粒子に包み込まれるようになり、やがて既存の細胞から離れていったようだ。
地球に発生した最初のウイルス粒子内には、おそらくは自己複製能をもつ分子群を持ち、そのためのエネルギーやタンパク質の原料を得るために必要ないくつかの成分が膜に備わっていたようだ。
RNAの役割における進化過程では、初期の細胞の遺伝情報は、DNAが未だ存在しないため、RNAに組み込まれていたようだ。RNAとDNAの化学構造の違いから、RNAが先行する証拠がいくつか見られる。リボースはリボ核酸(RNA)にはD-リボース、デオキシリボ核酸(DNA)にはデオキシ-D-リボースが含まれる。現代の細胞でも、RNAが触媒する重要な反応がいくつかある。
今までの分子生物学では、セントラルドグマ「DNA➡RNA➡タンパク質」のモデルがあり、DNAの暗号コードが各々の生物種の最重要設計図と理解されてきた。しかしながら、生物は、DNAにコード化した遺伝情報を、いつどう読み取るか、一時的に上書きして使うかなど、RNA分子が主体的制御分子として柔軟に制御を統括しながら生命活動を維持している。
 しかもRNA分子自体、遺伝情報を保有し、分子内・分子間の相互作用により、複雑な立体構造を築く触媒活性を担う。DNAの暗号コードcodeを、RNAがそれを読み解くdecode、それがセントラルドグマcentral
dogmaの中核である。しかし、1970年にある種のウイルスにより、RNAからDNAが合成されるという現象が発見(逆転写酵素の発見)されたため、セントラルドグマが一部書き換えられた。またその後、特に高等生物において、翻訳の前にスプライシング(splicing)の過程があることも判明した。この結果、セントラルドグマは3段階から4段階へ修正された概念となり、セントラルドグマに関わる分子機構が明らかになり、mRNA・tRNA・遺伝暗号などが発見され、その詳細が解明されると遺伝子発現が定義されるに至った。
しかもRNA分子自体、遺伝情報を保有し、分子内・分子間の相互作用により、複雑な立体構造を築く触媒活性を担う。DNAの暗号コードcodeを、RNAがそれを読み解くdecode、それがセントラルドグマcentral
dogmaの中核である。しかし、1970年にある種のウイルスにより、RNAからDNAが合成されるという現象が発見(逆転写酵素の発見)されたため、セントラルドグマが一部書き換えられた。またその後、特に高等生物において、翻訳の前にスプライシング(splicing)の過程があることも判明した。この結果、セントラルドグマは3段階から4段階へ修正された概念となり、セントラルドグマに関わる分子機構が明らかになり、mRNA・tRNA・遺伝暗号などが発見され、その詳細が解明されると遺伝子発現が定義されるに至った。 1960年初頭には、遺伝子は、遺伝子からタンパク質へと流れるという「セントラルドグマ」が定説として受け入れられた。遺伝子がタンパク質の作成を指令し、その遺伝子はDNAに存在する。mRNAはその仲介者として、DNAからリボソームribosomeへ遺伝情報を運ぶ。そのリボソームによりRNAからタンパク質を形成するための翻訳がなされる。
1960年初頭には、遺伝子は、遺伝子からタンパク質へと流れるという「セントラルドグマ」が定説として受け入れられた。遺伝子がタンパク質の作成を指令し、その遺伝子はDNAに存在する。mRNAはその仲介者として、DNAからリボソームribosomeへ遺伝情報を運ぶ。そのリボソームによりRNAからタンパク質を形成するための翻訳がなされる。リボースは、グルコースなどの簡単な炭水化物と同様に、原始地球を想定した実験の主要生成物の1つホルムアルデヒド(HCHO)から簡単に生成される5個の炭素をもつ単糖類の一つである。リボースは、ヒトの体のすべての細胞で使用され、エネルギー代謝に重要な化合物である「生体のエネルギー通貨」と呼ばれるATP(Adenosine Triphosphate:アデノシン三リン酸)の構造の一部となっている。
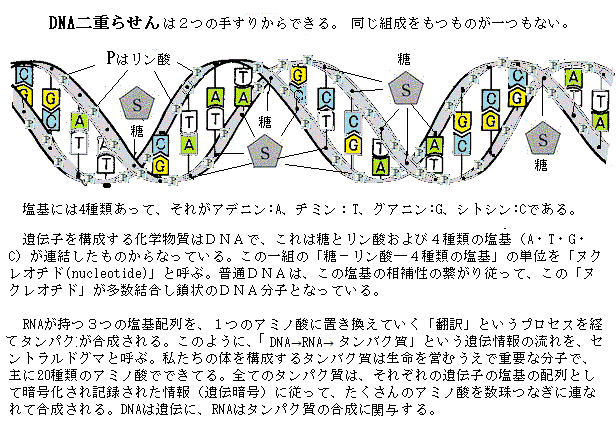
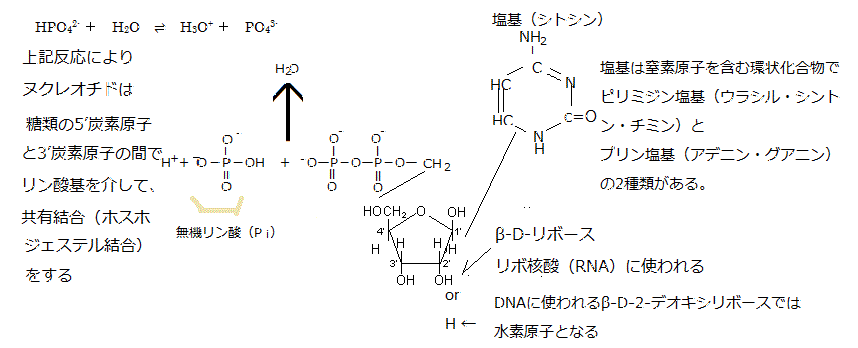
またRNA(ribonucleic acid:リボ核酸)のヌクレオチドは、リボース・リン酸・塩基から構成される。同じヌクレオチドの重合体であるDNA(deoxyribonucleic acid:デオキシリボ核酸)と深い関わりがある。
ヌクレオチドnucleotideとは、塩基と五炭糖が結合したヌクレオシド(=塩基+五炭糖)に、リン酸基phosphate groupが結合した物質である(ヌクレオチド=塩基+五炭糖+リン酸)。語源は「nucleo(核の)tide(結ばれた)」と言う意味である。
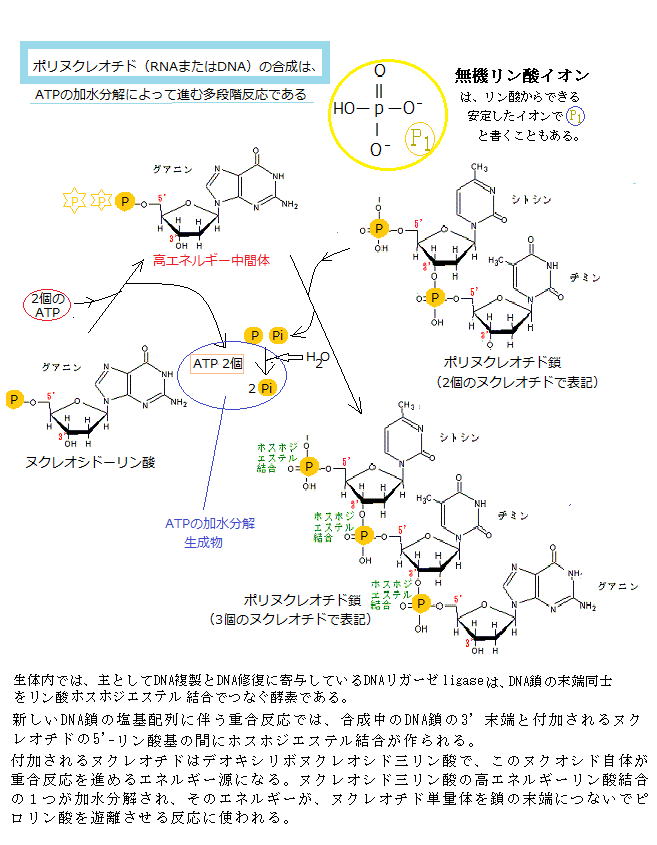
RNAとDNAは、いずれもヌクレオチドを構成単位にし、そのヌクレオチドは、塩基と呼ばれる窒素を含む環状化合物が五炭糖pentoseに結合したヌクレオシドのそれぞれの五炭糖における5’炭素原子 と3’炭素原子の間でリン酸基とヒドロキシ基hydroxy group(-OH)の間でホスホジェステル結合phosphodiester bondしている。
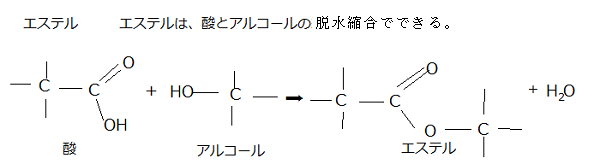
 ホスホジエステル結合とは、リン酸のカルボキシ基carboxy group(R-COOH、化学式は-C(=O)OH)が2個のアルコールのヒドロキシ基(R'-OH)とエステルester
(R-COO-R')を作り結合を言い、炭素原子の間を、リン酸基を介した2つのエステル結合によって強い共有結合する様式のことを言う。それにより地球上のすべての生物のDNAやRNAの骨格を形成する。
ホスホジエステル結合とは、リン酸のカルボキシ基carboxy group(R-COOH、化学式は-C(=O)OH)が2個のアルコールのヒドロキシ基(R'-OH)とエステルester
(R-COO-R')を作り結合を言い、炭素原子の間を、リン酸基を介した2つのエステル結合によって強い共有結合する様式のことを言う。それにより地球上のすべての生物のDNAやRNAの骨格を形成する。核内の五炭糖がβ-D-リボースかβ-D-デオキシリボースのいずれかでも、β-D-リボースが使われればリボ核酸(RNA)となり、β-D-デオキシリボースが使われればデオキシリボ核酸(DNA)となる。
しかし、デオキシリボースの生成は難しいが、現存細胞では、酵素を触媒とするリボソームにより合成される。
核には、核小体nucleolusと呼ばれる粒子状のものが密に詰まった部位がある。ここでリボソームが合成される。一般的な細胞には一つの核に一つの核小体があるが、複数の核小体を持つものもある。
核小体は通常、離れて存在しているが、何本かの染色体が中ほどの領域(核小体形成領域)で集合して核小体を形成する。その核小体に、リボソームタンパク質とrRAN(ribosomal RAN)が会して大小のサブユニットを形成し、そのそれぞれが核膜孔を通って細胞質に運ばれ、そこでも再集合してかなり多数のリボソームを形成する。
リボソーム上では、tRAN(transferRAN)が運んできたアミノ酸が多数重合してポリペプチド鎖が伸びていく。それがタンパク質の合成である。言い換えれば、遊離したまま集合したリボソーム上か、小胞体に付着して集合したリボソーム上か、そのいずれかで遺伝子コードの翻訳tanslationが完了する。
ここに遺伝子発現の基本的過程である転写・プロセシング・細胞質への輸送、そして翻訳で完了する。
細胞内では、リボースがデオキシリボースに先行して発生するが、後発のDNAの方がRNAよりも遺伝情報が永久保存に適し、特に糖-リン酸主鎖のデオキシリボースのDNA鎖の方がRNA鎖より化学的に格段に安定しており、進化すれば当然長くなるがそれでも切れにくい。一方、DNA鎖に比べて、1本鎖であるRNA鎖の方が化学的に不安定あるが、その分、反応性に富んでいる。
ウイルスの世界では、植物に感染するウイルスの殆どがRNAゲノムを持つ。動物でも半分はRNAウイルスである。SARSや鳥インフルエンザなどの、新興・再興ウイルスの殆どもRNAゲノムを持つ。
エイズの原因となるヒト免疫不全ウイルス(HIV)は、レトロウイルスである。他のレトロウイルスと同様に、HIVゲノムは、感染細胞の染色体に埋め込まれプロウイルスとして潜伏し続けることができる。こうして宿主細胞に潜まれると、抗ウイルス薬の効能が妨げられる。その一方、HIVの逆転写酵素は、宿主細胞には有害なだけで不要なので、現在、この酵素を主要な標的にする治療薬が開発されている。
目次へ
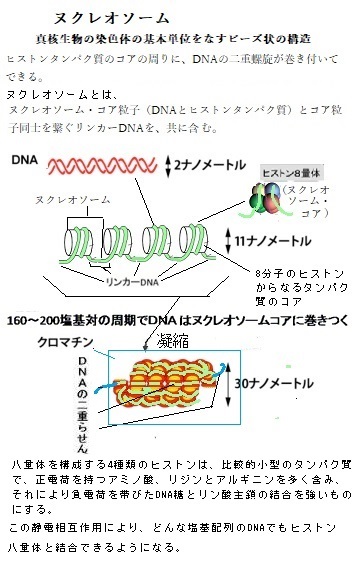 動く遺伝子は、トランスポゾンtransposon、あるいは転移因子transposable elementとも呼ばれている。トランスポゾンは、細胞内においてゲノム上の位置を転移transpositionすることができる塩基配列である。DNA断片が直接転移するDNA型と、転写が逆転写の過程を経るRNA型とがある。トランスポゾンという語は狭義には前者のみを指し、後者はレトロポゾンretroposonと呼ばれる。レトロポゾンはレトロウイルスの起源である可能性も示唆されている。
動く遺伝子は、トランスポゾンtransposon、あるいは転移因子transposable elementとも呼ばれている。トランスポゾンは、細胞内においてゲノム上の位置を転移transpositionすることができる塩基配列である。DNA断片が直接転移するDNA型と、転写が逆転写の過程を経るRNA型とがある。トランスポゾンという語は狭義には前者のみを指し、後者はレトロポゾンretroposonと呼ばれる。レトロポゾンはレトロウイルスの起源である可能性も示唆されている。細菌に最も多い動く遺伝因子は、DNA型トランスポゾンと呼ばれている。この場合、別の動く遺伝因子と違ってRNAを介在することなく、DNA断片として別の場所へ移動する。細菌は、様々なDNA型トランスポゾンを、DNA配列の中に多数含んでいる。それがヒトの寿命を縮めてきた。
DNA型トランスポゾンは、単純な切り貼り機構によって標的DNAの部位に移動するものがある。遺伝因子は供与側のゲノムから切りに離されて別の部位に挿入される。その一方、元の遺伝因子の配列をコピーして、新たな染色体部位にトランスポゾンのDNAが複製されるものもある。
いずれのやり方で移動するかはトランスポゾンによって決まるが、それにかかわる酵素には、それほどの差異がないため、どちらの方法でも移動できるトランスポゾンもある。
個々の動く遺伝子には、移動に関与するトランスポザーゼtransposaseという特殊な酵素の遺伝子を持つものが多い。この酵素は、個々の動く遺伝因子に存在する独自のDNA塩基配列を識別して作用する。また動く遺伝因子の多くは、別の遺伝子も持っている。例えば、細菌集団に抗生物質耐性が蔓延する主な原因となっている抗生物質耐性遺伝子を含んでいるものもある。抗生物質耐性遺伝子とは、抗生物質に対する耐性を与える遺伝子の総称で、抗生物質を分解したり、化学的な構造を変えたりする働きを持つ酵素などの遺伝子のことを言う。
アンピシリンAmpRやテトラサイクリンTetRなどの抗生物質を不活性化する酵素の遺伝子を持つトランスポゾンである。20世紀に開発された抗生物質に、数多くの病原菌が耐性を示すようになり医学界に深刻な問題をもたらしている。
目次へ
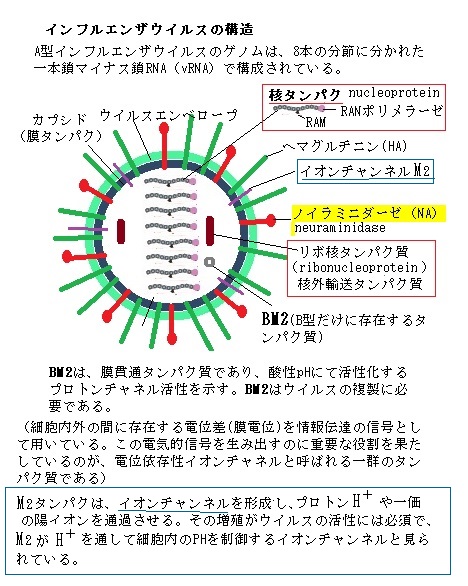
インフルエンザウイルスは、RNAを持つ大型の動物ウイルスで、タンパク質の外被は、更に脂質二重層のエンベロープenvelope(脂溶性の外膜)に包まれている。エンベロープの表面には、スパイクspikeとよばれる糖タンパクの突起が存在し、脂質二重層に埋め込まれている。
このようなインフルエンザウイルスにはA・B・Cの3型があり、流行的な猛威を振るうのがA型とB型である。A型とB型ウイルス粒子表面にはシアル酸を認識する赤血球凝集素(ヘマグルチニンhemagglutinin ;HA)とシアル酸を切断するノイラミニダーゼneuraminidase(NA)という2種類の糖タンパクならなるスパイクが沢山突き出た形をなしている。このHAが気道の上皮細胞の細胞表面にあるシアル酸を認識して結合し、その後、NAがシアル酸を切断して宿主細胞へ侵入してRNAを細胞内に送り込み増殖させる(ヘマグルチニンhemagglutininは、実験in vitroにおいて赤血球hemを固まらせて凝集体agglutinateを作ることから名付けられた)。これらが感染を防御する免疫抗体が標的とする抗原を作る。特にA型では、HAには15種類、NAには9種類の抗原性の異なる亜型が存在し、これらの様々な組み合わせを持つウイルスが、ヒト以外にもブタやトリなどの宿主に広く拡散していく。
A型インフルエンザでは、数年から数10年ごとに世界的な大流行が見られるが、これは突然変異による亜型のウイルスが出現して、従来のウイルスにとって代わることによって起こる。これを不連続抗原変異antigenic shift(抗原シフト)という。
ゲノムに生じる突然変異には、置換substitution・挿入insertion・欠失 deletion・重複duplication・逆位inversionなどがある。ウイルスゲノムにおける塩基置換は、ウ イルスで最も高頻度に観察されるが突然変異である。この「moving targets」に対処するには、ウイルスのゲノムとタンパク質の変化に関する情報の蓄積であるが、現在、自然界のウイルスゲノムの変異情報は急速に収集され、近縁ウイルスの分子進化系統樹を作製し、その分岐年代を特定して推定するなど、両方の解析結果が積み重ねられている。
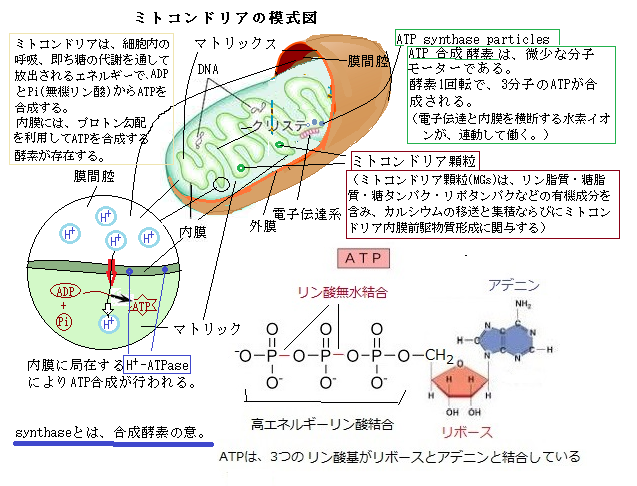 ヒトを含め真核細胞内には、核・ミトコンドリア・葉緑体以外にも、膜で包まれた小胞体・ゴルジ体・エンドソーム・ペルオキシソーム・リボソームなど細胞小器官がある。その殆どは、選択的透過性を持つ少なくとも1枚の膜に囲まれた小区画となって、細胞基質と隔てられいる。その多くは、細胞に必要な原材物質を取入れ、細胞内で生成した有用物質を細胞相互間で絶えず物質の交換をし、その一方、不要物の排出に関わっている器官が殆どである。例えば、リボソームは不規則な形の極めて小さな細胞小器官であるが、取り込んだ食物から栄養物を取出し細胞内で再利用し、不要な分子を分解し細細胞外に排出したりする。
ヒトを含め真核細胞内には、核・ミトコンドリア・葉緑体以外にも、膜で包まれた小胞体・ゴルジ体・エンドソーム・ペルオキシソーム・リボソームなど細胞小器官がある。その殆どは、選択的透過性を持つ少なくとも1枚の膜に囲まれた小区画となって、細胞基質と隔てられいる。その多くは、細胞に必要な原材物質を取入れ、細胞内で生成した有用物質を細胞相互間で絶えず物質の交換をし、その一方、不要物の排出に関わっている器官が殆どである。例えば、リボソームは不規則な形の極めて小さな細胞小器官であるが、取り込んだ食物から栄養物を取出し細胞内で再利用し、不要な分子を分解し細細胞外に排出したりする。例えば、細胞小器官からくびれて離れた輸送小胞が、別の細胞小器官に融合して交換を仲介する。細胞表面ではも、細胞膜の一部が陥入し、くびり取られるようにして小胞となり、そこに閉じ込まれた細胞外の物質を細胞内に運び込む。これをエンドサイトーシスendocytosis(飲食作用)と呼ぶ。
エンドサイトーシスは、膜動輸送の一つで、その細胞膜の形態変化により、細胞外から細胞内へ物質を取り込むが、不特定の物質を取り込む場合と、細胞膜上の特異的受容体に結合してから取り込まれる受容体介在型エンドサイトーシスがある。エンドソームendosomeは、エンドサイトーシスによって細胞内へと取り込まれた様々な物質の選別・分解・再利用などを制御し分子を選別し、一部は再利用のために細胞膜に送り返される。エンドソームを通過した異物に関しては、多くの酵素を含有するリソソームlysosomeに送られ酵素分解される。小さな細胞小器官であるペルオキシソームperoxisomeでは、脂質の分解や有毒物質の破壊など、様々な酸化反応に関わる酵素が含まれている。ミトコンドリアと葉緑体は、どちらも二重膜に囲まれ、それぞれ酸化的リン酸化と光合成の場となっている。
 真核細胞は、常にエンドサイトーシスにより細胞外物質を取り込み、エキサイトーシスexocytosis(開口分泌)によって細胞内物質を細胞外に放出する。
真核細胞は、常にエンドサイトーシスにより細胞外物質を取り込み、エキサイトーシスexocytosis(開口分泌)によって細胞内物質を細胞外に放出する。細胞内に取り込まれた細胞外の粒子や分子の多くや、細胞内の老化した細胞小器官は、最後に膜に囲まれた袋状のリソソームに送られる。リソソームには、タンパク質・核酸・オリゴ糖・脂質などを分解する、ほぼ40種類の加水分解酵素が含まれ、調節しながら細胞内消化を進めていく。リソソームは、内部の酸性環境(ほぼpH5)で最大活性をし、リソソームの膜は、その分解酵素を細胞基質(ほぼpH7)から隔離している。万一漏れ出しても、酵素の至適pHが酸性なので、細胞基質の内容物は被害を受けない。
受容体を介したエンドサイトーシスは、細胞膜を通過する輸送過程では取り込めないビタミンB12や鉄などの必須代謝産物の取り込みにも用いられる。ビタミンB12や鉄は、赤血球の主要なタンパク質であるヘモクロビンの合成には必須で、それぞれの受容体タンパク質と複合体を作り未成熟赤血球に取り込まれる。細胞外からのシグナルとなる物質に結合する細胞表面の受容体の多くも、この径路で細胞内に取り込まれる。
困るのは、この受容体を介したエンドサイトーシスの径路を、インフルエンザウイルスも利用して細胞内に侵入することである。
(細胞質基質cytosolは、細胞質cytoplasmから細胞小器官organellaを除いた液状成分であり、カリウムイオンなどのイオン類のほか、多くの酵素などのタンパク質やその原料であるアミノ酸を含み、また、溶け込んでいるブドウ糖などの解糖が行われる場である。細胞質基質のpHは7.0〜7.4程度の中性)
インフルエンザは、日本では、醍醐天皇の901(延喜)元年に完成した清和・陽成・光孝3代の歴史を編年体で記した勅撰国史「三代実録」に、862(貞観4)年「京城及畿内畿外。多患咳逆(しはぶき)。死者甚衆矣」と記される。これが日本のインフルエンザに関する最初の公式記録になる。この咳逆ことインフルエンザの大流行は、この年に終わらず貞観6年までと3年間続いたようだ。貞観7年4月5日(865年5月7日)の条に「去年天下患咳逆病。今年内外(内裏や諸司諸所=各省庁)疫氣有萠。故轉經(僧侶が教文を抜き読みする)攘之(これを払い除く)」と記している。
「増鏡」に、1,329(元徳元)年頃に「シハブキヤミ(咳病・咳逆・咳逆病、咳漱などの字が当てられた)」が流行したと記される。シハブキは咳のことを意味する。日本呼吸器学会の咳嗽(がいそう)の定義では、「咳嗽と、気道内に貯留した分泌物や異物を気道外に排除するための生態防御反応である」。その咳漱がインフルエンザの特徴を表している。
鎌倉時代からは咳病を「ガイビョウ」と音読するようになった。また、江戸時代の流行の際には、お駒風・谷風・お七風など時の有名人の名前が付けらもしたが、庶民は通常、風邪・風疾・流行風(はやりかぜ)と呼ぶ。そしてヨーロッパ大流行の時期(1729〜1730年)、日本でも、鎖国下であったが世界的な大流行に巻き込まれていた。
1,854(安政元)年の流行は、黒船で横浜沖に来た「ペリー再来航」頃であったため「アメリカ風」と名付けられた。
流行性感冒という病名は、1,890(明治23)年の春、日本でインフルエンザが大流行した時に、初めて呼ぶようになった新用語であった。
1,918(大正7)年にスペインかぜ(H1N1)が出現し、その後39年間続いた。これはトリ由来の 遺伝子をもったH1N1によって引き起こされた。第一次世界大戦の最中、3波にわたり全世界を襲う。第1波は1918年3月に米国北西部で出現、米軍とともに欧州に渡り、西部戦線の両軍兵士に多数の死者を出したため、戦争の終結を早めたと言われている。スペインの王室の罹患が大々的に報じられたことからスペインかぜと呼ばれるようになった。死亡者数は世界で少なくとも5,000万人と推測される。
1,957年にはアジアかぜ(H2N2)が発生し、11年間続いた。1,968年には香港型(H3N2)が現れ、ついで1,977年にソ連型(H1N1)が加わり、現在はA型であるH3N2とH1N1、およびB型の3種のインフルエンザウイルスが世界中で流行している。 一方、同一の亜型内でも、ウイルス遺伝子に起こる突然変異の蓄積によって、HAとNAの抗原性は少しずつ変化する。これを抗原連続変異antigenic driftという(antigenicとは、“抗原性の、抗原の”の意味)。インフルエンザウイルスでは連続抗原変異が頻繁に起こるので、毎年のように流行を繰り返す。
これまでのウイルスの変異研究では、ゲノム塩基配列の解析とウイルスの形質の解析が中心であった。これらの情報は全てのウイルス研究の出発点となり、未来に繋がる研究成果となって蓄積されている。そのウイルスの形質発現に直接関わる分子の多くは、タンパク質である。変異によるウイルスの変化を解析するためには、ウイルスタンパク質の構造と機能、その変化を解明する必要がある。そこで得られた情報は、創薬やワク チン開発に結びついている。
しかし、従来のタンパク質科学の方法論のみでは、自然界のウイルスから得られる膨大な変異情報に対処しきれていない。新たな方法論が再構築され、現在では、計算機を用いて生体高分子の立体構造予測と、タンパク基質と低分子化合物、あるいはタンパク基質間の結合シミュレーショ ンとタンパク基質間ネットワークや細胞・生体機能間のシミュレーションが高い精度にまで及ぶ研究が急速に進展している。これらの分野は、まとめて計算科学computational scienceと呼ばれる。この分野で研究されている様々な方法論のうち、タンパク質の立体構造予測とタンパ基質の低分子化合物の結合シミュレーションでは、実験で得られる結果と遜色ないほどの精度に描かれつつある。
目次へ
 生物に多様性diversityが生じるのは、遺伝子に突然変異が生じ、それにより構造や機能が変化した細胞や個体が生じるからである。多様性の原因は、遺伝子の変化により、共通の祖先から生じる多数の子孫の中に変異が蓄積され、構造や機能が大きく変化したものが現れるからだ。それらは、別の種類の生物として分岐していく。
生物に多様性diversityが生じるのは、遺伝子に突然変異が生じ、それにより構造や機能が変化した細胞や個体が生じるからである。多様性の原因は、遺伝子の変化により、共通の祖先から生じる多数の子孫の中に変異が蓄積され、構造や機能が大きく変化したものが現れるからだ。それらは、別の種類の生物として分岐していく。つまり、生物の単一性unityと多様性は、両方とも、遺伝子あるいはDNAに根源があり、ある生物の遺伝子のセットを、物理的にはDNA1セットを生物の「ゲノム」と呼ぶので、ゲノムに生物の根源が在るとも言える。
分子生物学は、主として遺伝子の働きと言う共通性と単一性を中心に学ぶ。それは、生物界全体が、どのような系統をたどっているか、また、それにはどのような進化的背景があるか、を知り、「一体、生物とは何なのか」を解明することに繋がる。
数百万種を超える生物を理解するためには、進化に基づく近縁関係によるグループ分け、具体的には。進化の過程で最近別れたもの同士は近縁関係にあり、古い時代に分かれたもの同士は遠縁にある、と言う原理に基づくグループ分けで、これを「自然分類」、あるいは「系統分類」と呼ぶ。一方、生物の系統関係を、進化に基づく枝分かれで表したものを「系統樹」という。
現在に生きる生物の系統を推定する一つの方法は、形態学や解剖学、発生学・生理学・生化学などの様々な手法で、生物相互の共通性と相違性を比較して、似た者同士をグループとしてまとめることにある。もう一つの方法は、進化の過程の物的証拠である化石について、年代を遡って比較することにある。
ヒトとチンパンジーは、700万年前に共通祖先から分かれた。現代に生きる現生人Homo sapiensは、20万年前に誕生したばかりである。
 近年では、恐竜から鳥類が分岐するあたりの化石が大量に発見されている。しかし、化石が見つからない古い時代における生物同士の分岐時点、例えばヒトとヘビの類縁関係にまでたどれる解析方法がない。
近年では、恐竜から鳥類が分岐するあたりの化石が大量に発見されている。しかし、化石が見つからない古い時代における生物同士の分岐時点、例えばヒトとヘビの類縁関係にまでたどれる解析方法がない。しかし、赤血球の中に含まれる酸素を運搬するヘモクロビンというタンパク質の構造は、様々な動物同士で比較が可能である。ヒトと他の動物では、ヘモクロビンを構成するタンパク質のアミノ酸が少しずつ違っていることが分かっている。ヒトとゴリラでは、互いに一つしか違わないが、ヒトとカンガールでは27個も違いがある。それぞれの共通先祖が分岐してからの年数の違いにより、両者が少しずつ積み重ねてきた突然変異の蓄積の差を示している。
タンパク質の構造をコード化しているのが遺伝子である。遺伝子はDNAと言う物質で作られている。そのため遺伝子に突然変異が生じることは、DNAの塩基配列が変化したことになる。それによりタンパク質を生成する遺伝子コードが変わり、それを構成するアミノ酸の分子が変わることを意味する。そのため、アミノ酸の変化量と化石研究の分岐年代と対比しグラフにすると、きれいな直線関係となって表れる。
タンパク質のアミノ酸の変化は、それが元になる遺伝子DNAの塩基配列の違いにより起こるものであるから、その多少により生物同士の分岐の時期が解析できる。時の経過とともに、DNAの塩基配列に生じる変化にともない、一定の速度で変化するアミノ酸の変数は「分子時計」と呼ばれ、進化に伴うタンパク質のアミノ酸の分子変化は、「分子進化」と呼ばれ、それは「遺伝子の進化」であれば、その解析により生物同士の分岐時期が推測され、互いの類縁関係の遠近が読み解けるようになる。
生物それぞれは、進化を積み重ねてきたため、余りにも多種多様な形態を持つようになる。そのため、人類は、その存在自体の意義を常に問い掛けてきた。
地球と言う、大陸までも消滅させ、しかも新たに誕生させる大変動を幾度も繰り返すその基盤は、余りにも脆弱すぎるため、現代にまで生き残った生物は、無限とも言える奇跡的な幸運に恵まれ生き延びてきた。そこに頼らざるを得ない地球上の生物は、度し難い難題に直面しながら、単なる自然淘汰と言う言葉以上に、子孫の存続のために、化学と物理の原理を積み重ねる反応を昇華させ、単一性と多様性が混在する現代の生物の姿となって現れた。
目次へ
 Epigeneticsエピジェネティクスとは、DNAの配列の変化を伴わない遺伝子発現を制御・伝達するシステムや現象を扱う学術領域のことを言う。
Epigeneticsエピジェネティクスとは、DNAの配列の変化を伴わない遺伝子発現を制御・伝達するシステムや現象を扱う学術領域のことを言う。Epigeneticsの「epi」は、ギリシャ語で「優位」や「上に」、或いは「after」という意味の接頭語であり、細胞分裂を通して娘細胞に受け継がれる現象を端的に伝えている。
つまり、遺伝的な特徴を持続しながら、突然変異などのDNA塩基配列の変化が付随しない、遺伝子の発現の違いによる「エピジェネティクな制御」「エピジェネティクな変化」を対象にする研究を言う。
遺伝子が細胞から子孫細胞progeny cell(progeny;子孫・子供たち)へ性質を伝える現象を「遺伝heredity(hɪrédəṭi相続・世襲)」という。遺伝子に起きた変化、突然変異mutation(mjuːtéɪʃən変化・変更・転換)は、子孫細胞に伝わる。これをジェティックgeneticな性質と言う。これに対してコード化された遺伝情報を変更することなく、個体発生や細胞分化の過程で、遺伝子の発現を制御する過程を総称して、epigeneticsと呼ぶ。
実際、分化した細胞は、エピジェネティックな仕組みによって、その独自性を保っている。一度、特定の細胞に分化した細胞は、その後も、その分化状態を維持継承したまま、同じ型の子孫細胞を作る。例外もあり、骨格筋細胞やニューロンのように、高度に専門化した細胞は、最終分化したもので、以後、細胞分裂自体が生じない。また、平滑筋細胞(動物の筋肉組織の一つで、主に胃や腸などの内臓筋に見られ、膀胱・子宮・血管壁などにも分布する)・線維芽細胞(皮膚の機能を保つ上で最も重要な細胞で、創傷治癒の際に重要な働きをする)・肝細胞などのように、分化後も個体が機能を停止するまで、分裂を繰り返すが、他の細胞には分化できない。 細胞が独自の型のまま増殖する細胞記憶cell memoryにより、その独自性を保つ遺伝子発現パターンが、分裂細胞後の娘細胞にも伝達されている。しかも一度始まると、各々の転写調節因子の生産機構も含め受け継がれていく。その永続性を支えるためには、細胞自体に、自分どういう機能があるのかを、自分の娘細胞に確実に伝達し記憶させる仕組みが備わっていなければならない。 その最も簡単で重要な仕組みが、正のフィードバックループpositive feedback loopである。
それは、鍵となる転写調節因子が、細胞の型に特異的な遺伝子とともに、自分自身の遺伝子の転写機構を活性化する方法である。細胞分裂の度ごとに、調節因子も娘細胞に分け与えられ、そこで正のフィードバックループの刺激が続けられる。これらの刺激が連続するのは、それ以降に世代を重ねる娘細胞が、必ず調節因子を作り続けることで、「自己維持的な」遺伝子回路を築くには欠かせない仕組みとなり、それぞれの細胞ごとに定められた運命を歩ませ、その仕組みを構成し調節する機構を伝承する回路となるがためである。
そのためのマスター転写調節因子と呼ばれるタンパク質は、自己自身の転写と、その細胞の種類ごとに付与された特異的遺伝子の転写を活性化させる。それにより、子孫細胞のすべてが、元の親細胞の一過性のシグナルを受け継ぎ、マスター転写調節因子を作り始める。
自分がどう言う種類の細胞になる運命なのかを、記憶させる方法で最も主流となるのが、この正のフィードバックループである。 エピジェネティックな違いは、遺伝子の構造そのものの違い、即ちジュネティックgeneticな違いではなく、その遺伝子の働き方の違いであるが、そのエピジェネティックepigeneticsな遺伝子発現が細胞内に一生働き続ける。
目次へ
細胞の発生は、受精卵から始まる。その後、エピジェネティックな変化を積み重ねながら、発生初期における、受精卵の細胞分裂(卵割)により、受精卵の表面にくびれが生じ、2つに分割され、更にその2つが分割され、2細胞期、4細胞期と初期過程が進行し、細胞の数が倍増していく。やがて、胚形成初期の初期胚(ヒトでは胚盤胞blastocysts)になると、内部細胞塊embryoblastとその表面を覆うトロフォブラストtrophoblast(栄養膜細胞)に分化する。
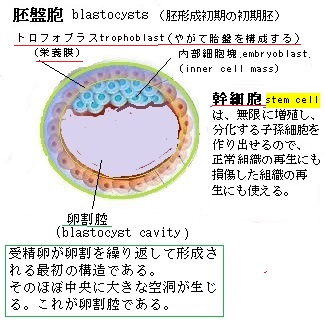 内部細胞塊と言う初期胚の細胞は、体のすべての細胞になり得る幹細胞でもある。ES細胞embryonic stem cell(胚性幹細胞)は、この内部細胞塊の細胞を培養系で維持・増殖したものである。
内部細胞塊と言う初期胚の細胞は、体のすべての細胞になり得る幹細胞でもある。ES細胞embryonic stem cell(胚性幹細胞)は、この内部細胞塊の細胞を培養系で維持・増殖したものである。「胚性幹細胞」とは、胚の内部細胞塊を用いて作られた幹細胞であるため「万能細胞」と呼ばれる。
1981年に、マーティン・エヴァンス博士(イギリス・カーディフ大教授)が、マウスの初期胚から様々な細胞に分化する能力を持つES細胞の樹立に成功した。マウスES細胞の樹立には、胚性幹細胞の性質を保持したまま増殖させるために、フィーダーレイヤー法feeder layer methodと呼ばれる、胚性幹細胞の増殖や分化に必要な環境を整えるための特別な培養液の開発が必要であった。胚性幹細胞とは異なる種類のフィーダー細胞feeder cellと共培養することで、フィーダー細胞が産生する細胞成長因子や細胞外マトリックス(細胞外基質、細胞から分泌された多糖“グリコサミノグリカンやセルロースなど”とタンパク質“主に脊椎動物の真皮・靱帯・腱、・骨・軟骨などを構成するタンパク質の一つコラーゲンなど”からなるゲルgel“半固体ないし固体の状態になった溶液”で、互いに連結した複雑な網目の組織構造を作る要素であり、組織の形成や生理作用を担う)を活用する技術を言う。ES細胞の培養では、フィーダー細胞としてマウスの線維芽細胞が用いられている。
ES細胞は、胎盤にはなれないが、胎児のあらゆる細胞になる能力を持った幹細胞で、初期胚に由来する胚性幹細胞embryonic stem cellであり、能力的には多能性幹細胞pluripotent stem cellである。
iPS細胞induced pluripotent stem cellsは、平成18(2006)年、山中伸弥教授の京都大学再生医科学研究所の研究グループによってマウスの線維芽細胞から作られた。人のiPS細胞は、人の皮膚から摂取した線維芽細胞から作られている。ES細胞がヒトの有精卵細胞を原料に使っているのに対して、iPS細胞は線維芽細胞を使っているため、原料の採取も培養も非常に簡単である。
ES細胞は発生初期の胚の細胞からつくられるため、受精卵に非常に近い能力を持っている。しかも、ES細胞は半永久的に維持でき、目的の細胞へと分化させることができることから、再生医療のソースとして大きな期待が集まった。しかし、ES細胞から細胞や臓器をつくることができたとしても、それは移植される患者にとっては、他者の細胞であるために、臓器移植と同じように拒絶反応の対象になる。
目次へ
| 9)幹細胞と増殖性の前駆細胞 生物学では、クローンcloneを、単一の祖先細胞に由来する、基本的には遺伝的に同一の細胞、または同じ遺伝情報を共有する子孫の集団と定義する。明治36(1903)年、後にカリフォルニア大学教授に就任したハーバート・ジョン・ウェバーが、遺伝的に同一の細胞群、個体群を指す生物学用語として「clone」という語を考案した。クローン技術は、植物では、古くからの増殖方法で、種子に頼らないチューリップの球根・アジサイの挿し木・ヤマイモの種芋などの手法である。植物の組織の一部を切り取って再生させる組織培養は、天然記念物の樹木など貴重な植物の保存・増殖に利用されている。日本全国で数百万本あると言われているソメイヨシノは、接ぎ木によってのみ殖やす代表的なクローンで、遺伝的には親と全て同じ性質を備えているクローンは、農林1号と農林22号という品種をかけ合せて作られたコシヒカリも同様と言う。 多細胞動物の完全な生きたコピーを作るクローニングreproductive cloningとは、全く別の手法で、最も単純なのは、培養系での細胞のクローニングである。例えば、皮膚から1個の表皮幹細胞を採取し、培養して増殖させると、遺伝的に同一の表皮細胞のクローンが得られる。 特殊化、即ち分化した細胞の大部分は、次々と再生して交代する必要がある。しかし、赤血球・皮膚表面の表皮細胞・腸上皮の吸収細胞と杯細胞goblet cell(鼻粘膜上皮内には杯細胞があり、特に腸管や気管などの粘膜上皮に多い、粘液を分泌する細胞である)は、自ら分裂できない最終分化に入った細胞である。その最終分化細胞が失われて入れ替わる細胞は、増殖性の前駆細胞から作られる。この前駆細胞も、増殖性と言うが自己再生ができず、前駆細胞に比して極めて少数である幹細胞から生まれることになる。幹細胞の分裂で作られた娘細胞は、通常、前駆細胞になり、決められた数の分裂を終えた前駆細胞から最終分化するか、幹細胞に留まるか、どちらか一方をたどる。 幹細胞と増殖性の前駆細胞は、分化した細胞のように専門の機能を持たず、専門機能を担う娘細胞を生み出す役割を果たしながら、分化した細胞と一緒に、それぞれの組織の中に保持されている。幹細胞は分化しないため、それが含まれる動物生体の一生を通じて分裂される。幹細胞が分裂して2つの幹細胞ができることも、幹細胞の蓄えが保たれていれば、2つの前駆細胞ができることも、更には、1つは自己再生して幹細胞に、別の1つは増殖性の前駆細胞にもなる。 通常、幹細胞は少数しか存在せず、多くは外見上の特徴がないため同定は難しいと言う。ただ、幹細胞と前駆細胞は、正常な条件下では一群の転写調節因子を安定して発現し、子孫細胞への分化が適切に行われるように働くことが、発生時に仕組まれ、既に方向づけられている。 例えば、小腸の内壁では、微絨毛と呼ばれる小さい突起が密生する。そこには、吸収を行う刷子縁細胞brush border cell(さっしえんー)とその間に散らばる粘液を分泌する杯細胞が単層の上皮を作り、この層が腸の内壁に指状に突き出し絨毛の表面を覆い、表面積の拡大に寄与している。その下の上皮細胞にある無数の小さな管状の窪み、それを陰窩intestinal crypt(いんか;intestinal=「腸の」;crypt=「地下室」)と呼ぶ。それが、上皮に食い込んだ状態で連続しているが、幹細胞は、その陰窩の底近くに存在している。その幹細胞から生じる大部分は、増殖性の前駆細胞で、それが上皮層内を上に向かって移動しながら、最終分化して分泌細胞か吸収細胞になり、それらがヒトの場合では、3~6日間で絨毛の先端に到達すると、腸の内腔に脱落して死んでいくという新陳代謝が行われている。 腸上皮の細胞は、消化酵素など、様々な物質にさらされる過酷な環境下にある。腸内の物質は、ヒトを含む動物が食べた食物により、時々刻々大きく様変わりする。上皮細胞は、草本類などが保有する食害防御のための有害物質や、あたり前のように環境中に広く分布する変異物質にさらされる。その極めて過酷な状況下で、その防御で消耗した上皮細胞の新陳代謝が迅速であれば、生体の組織全体の健全性が保たれる。 上皮細胞に変異や損傷が生じても、短日に、その細胞や子孫細胞が絨毛から押し出されるため、細胞の変異が高頻度に起きても、その癌化をある程度防いでくれる。 一方、千数百億個もの神経細胞・ニューロンneuronが構成する脳の情報処理の場は、ニューロン相互の精緻で複雑な巨大なネットワークとなっているため、外界から隔離され保護されている。その系統は発生の過程で作られるため再生は容易ではない。 皮膚の表皮(上皮)では、その一番底の基底膜に接着して増殖性の幹細胞と幹細胞から分裂した前駆細胞が混在している。前駆細胞は、その底の層から出ると直ぐに分裂を止め、外部に向かって垂直に移動しながら分化する。やがて、最終分化した細胞の核や細胞小器官が崩壊し、細胞は縮んで平たい鱗状になり、やがてその残骸は皮膚表面からはがれ落ちる。 1種類の幹細胞から幾種類もの分化した子孫細胞が生じることは通常ありうる。小腸の幹細胞から吸収細胞や杯細胞が作られるし、血液細胞を作る造血過程では、骨髄にある造血幹細胞が、酸素を運ぶ赤血球や免疫反応して生体防御に働く種々の白血球White blood cellを作り出している。 白血球は、身体の組織に侵入した細菌や異物を取り込み、分解・消化する免疫抗体を作る。白血球の増減は、細菌の侵入や、炎症が起きていることを示す指標となる。そのため、病院の臨床検査では、日常的に使われている。 血液中には、1種類の幹細胞に由来する様々な細胞が循環している。特に種類が多い細胞が白血球で、好中球・好酸球・好塩基球・リンパ球・単球などの細胞がある。 目次へ |
| 10)iPS細胞 幹細胞は無限に増殖し、分化する子孫細胞を作り出せる。そのため、正常組織の再生や損傷して失われた組織の修復も可能になる。患者自身の造血幹細胞を、あらかじめ採取・保存しておき、大量化学療法による移植前処置後に投与する方法は、病気の治療に大きな可能性を秘めている。 人間の皮膚など、本来、分化多能性pluripotencyを喪失している体細胞に、ごく少数の多能性誘導因子を導入し、分化細胞を未分化の細胞に初期化する。4つの遺伝子「Oct3/4(オクトスリーフォー)」・「Sox2(ソックスツー)」・「Klf4(ケーエルエフフォー)」・「c-Myc(シーミック)」が、初期化を誘導する多能性誘導因子であることが明らかになり、これらの遺伝子をヤマナカファクター(山中因子)とも呼ぶ。その多能性幹細胞を培養することによって、様々な組織や臓器に分化する能力のある細胞群や、ほぼ無限に増殖する能力を持つ幹細胞の生成に繋がる。 特に、ヒトのiPS細胞により、ヒトの特定に分化した細胞の均一集団を大量に培養して、薬効が期待される薬による、特定の細胞に与える効果や副作用を調べることができる。また、遺伝性疾患の患者のゲノムを持つiPS細胞を作り、患者の特異的な幹細胞を生合成して病気の仕組みを解明し、治療薬の開発に役立てる。 iPS細胞induced pluripotent stem cell(人工多機能性幹細胞)は、未受精卵や授精卵を使わずに、体細胞を直接初期化し受精卵と同等の細胞を作ることではないか。つまり、「卵子は使わず」「体細胞を素材にして」「既知のたった4種類の遺伝子を導入して」「ES細胞と同一の細胞を作る」ことにある。 未受精卵には、体細胞の核を初期化する能力や、胞胚の内部環境にEC細胞embryonal carcinoma cell(胚性癌細胞;carcinoma=癌種)の悪性腫瘍としての性質を正常幹細胞(ES細胞)に変化させる能力があることが知られている。EC細胞は、胚性癌腫細胞とも呼ばれ、悪性奇形腫から発見され、初めて体外で培養された多能性幹細胞であり、ES細胞の作製の元となった。EC細胞は癌細胞ではあるが、未分化で分化全能性を持つ胚細胞に似ている。EC細胞株は未分化状態のままシャーレ上で維持することができ、さらに特定の薬剤添加などにより、様々な細胞に分化誘導することができる。 ES細胞やEC細胞の能力の実体は、未だ、分子レベルでは明らかでない。そのため体細胞を初期化することは、できないと思われていたが、iPS細胞の完成により、全能性の分子レベルの解析ができないまま体細胞の初期化に成功した。 その背景には、平成15 (2003)年に、ヒトゲノムの全塩基配列が分かり遺伝子の全体像が明らかになり、様々な組織や細胞の解析が進んだことにある。遺伝子発現の全体像、即ち発現しているmRNAの全体像transcriptome(トランスクリプトーム=ゲノムから転写されるmRNAの総体)、発現しているタンパク質の全体像、代謝産物の全体像などの解析がなされてきた。 特に、トランスクリプトーム解析は、特定の状況下で、ある組織や細胞中に存在する全てのmRNA(transcripts)の種類やどれだけ合成されているかなどの総体を調べ上げ、転写活性を特徴づけ、関連するターゲット遺伝子や転写産物のサブセットにもフォーカスし、数千もの遺伝子を一度にプロファイリングして細胞機能の全体像を描出する。遺伝子の全体をゲノムと言うように、転写されたmRAN(transcripts)の全体をトランスクリプトームと呼ぶ。 トランスクリプトームの状態は、同一種の生物でも、臓器・組織・細胞の種類により異なり、同一細胞でも、老化や病気など生理的機能が変化すれば当然変化する。これらを網羅的に数値化出来れば、 正常な機能の理解に繋がり、癌などの治療で、トランスクリプトームの変化の解析で適切な治療法が見つかる。 その研究の中で、ES細胞の特徴的な遺伝子発現の解析により、多能性幹細胞に特有な遺伝子群のトランスクリプトーム解析がなされ、マウスでは約100種類の遺伝子が、ES細胞に特異的に発現されていることが報告された。山中教授の研究室は、ES細胞を幹細胞ならしめている遺伝子を発見して、体細胞に導入して働かせれば、体細胞をES細胞に変えることができると考えた。しかし実験に用いたマウスの線維芽細胞は、当然、線維芽細胞としての遺伝子発現がなされている。受精卵から最終分化細胞である線維芽細胞になるまでには、エピジェネティックな遺伝子発現の変化を精緻なプロセスを経て積み重ねてきた。 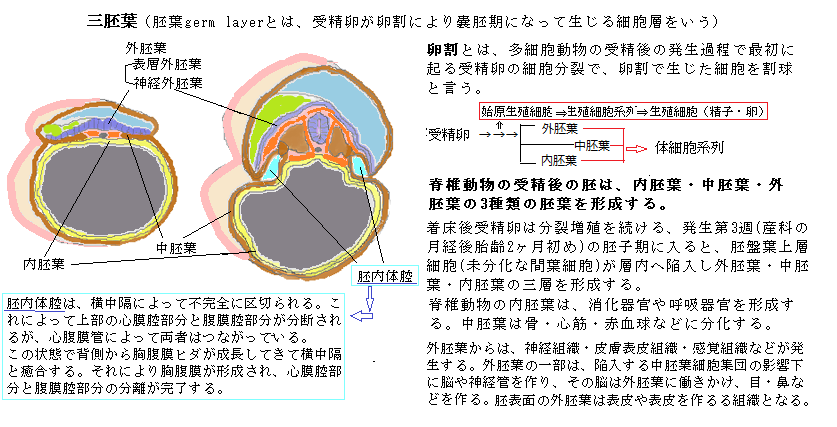 受精卵から、胞胚の内部細胞塊が生じ、体の基本となる体軸として、頭尾軸・背腹軸・左右軸の3つが決まり、これらの軸に沿って体が形成されていく。受精後の胚は、内胚葉・中胚葉・外胚葉の3種類の三胚葉を形成し、内胚葉は、消化器官や呼吸器官を形成、中胚葉は骨・心筋・赤血球などに分化、外胚葉は、神経や感覚器官を構成するが、その三胚葉への分化を経て、予定された一定のプロセスを進行させ、分化の方向性が定まる各段階の幹細胞から、ようやく最終分化細胞である線維芽細胞になるという多段階の過程をたどってきた。その分化の終末段階にある線維芽細胞に、ES細胞で発現している遺伝子を導入し発現させれば、いきなり多能性幹細胞ができるなどとは想像できなかった。 ただ、ES細胞と体細胞を細胞融合させると、融合した細胞はES細胞の性質を示す、と言う実験結果があった。つまりES細胞で発現している遺伝子の何かよって、体細胞の機構より優性に働き、体細胞が示す性質を上回るか、その性質を打ち消していているように見える。しかも、この実験結果は、ES細胞が体細胞より優性であるためには、ES細胞を積極的に存続させる遺伝子 があることを示唆していた。 実際にiPS細胞の開発には、多くの技法と周到な準備と膨大な労力が必要な本格的なプロジェクトであった。 最初に、山中教授の研究室では、遺伝子の転写を調節するタンパク質の遺伝子を、約100種類の候補遺伝子の中から、予備的な検討により24種類に絞り込んだ。また、細胞に遺伝子を効率よく導入するために、適切な量を発現できる発現ベクターexpression vectorを用意し、これを各遺伝子に組み込んだ。 vector とは、ラテン語「vehere」に由来し、「運び屋」を意味する。Vectorは、特に遺伝子組み換え実験の際に頻繁に用いられ、挿入する遺伝子断片の大きさや挿入目的によって、それを挿入するための様々な遺伝子の調節配列を付加した媒体がVectorとして使い分けられている。 発現ベクターとは、DNAの組み換え実験の際に、クローニングした遺伝子を発現させるため、他の細胞または核内にクローニングした遺伝子の運び込む役をするDNA分子であり、DNAの組み換え目的に合わせて、タンパク質情報を持つDNAを、発現ベクターに挿入して他の細胞に導入する。導入する細胞の種類に合わせて、それに適した転写や翻訳の調節配列を持ついろいろな発現ベクターが設計されている。 発現ベクターを導入されるマウスの線維芽細胞が、ES様細胞に変化したら緑の蛍光を発し、その上でES様細胞に変化した極少数の細胞を選択できるように、不要な細胞は殺す仕組みを施した。 24種類に絞り込んだ遺伝子をすべて、線維芽細胞に導入して発現させると、ES様細胞に変化した細胞が、極めて僅かに出現した。その後の実験を大胆に要約すると、24種類の遺伝子を一つずつ減らし、それによりES様細胞が出現しなくなったものが、ES様細胞化に必要な遺伝子と同定した。 最後に残った4つの遺伝子「Oct3/4(オクトスリーフォー)」・「Sox2(ソックスツー)」・「Klf4(ケーエルエフフォー)」・「c-Myc(シーミック)」が、初期化を誘導する多能性誘導因子であることが明らかになり、これらの遺伝子をヤマナカファクター(山中因子)とも呼ぶ。たった4種類の「山中因子」を、マウスやヒトの線維芽細胞に導入することで、線維芽細胞に特有な遺伝子の発現が消滅し、ES細胞特有の遺伝子が一斉に発現し、ここにiPS細胞が誕生した。  iPS細胞でも、分化細胞特有のメチル化がはずれ、ES細胞で発現する幹細胞特有の遺伝子が高発現するようになり、それに応じて、4つの多能性誘導遺伝子は、プロモーターがメチル化されて発現が低下した。 iPS細胞でも、分化細胞特有のメチル化がはずれ、ES細胞で発現する幹細胞特有の遺伝子が高発現するようになり、それに応じて、4つの多能性誘導遺伝子は、プロモーターがメチル化されて発現が低下した。しかも、iPS細胞の娘細胞に分化が進行すると、次第に幹細胞特有の遺伝子の発現が低下していった。 iPS細胞を使う再生医療への期待は、余りにも大きいが、応用研究には、様々な課題があり、解決への模索が現在でも、世界中で続けられている。 課題の1つ目が、患者本人の細胞からiPS細胞を作る成功率の上昇である。2つ目が、中途半端に初期化した細胞を除去し、完全にES細胞になったiPS細胞だけに絞り込み選択できるかである。この課題は、現代では、大いに改良が重ねられている。3つ目が、「山中因子」の「c-Myc(シーミック)」遺伝子が、発現昂進によって癌遺伝子として作用することにある。これも事実上、癌化を完全に阻む研究の成果が積み重なり、癌化の恐れはなくなっている。4つ目が、iPS細胞から作られた分化細胞とそれが形成する組織に、一つでも元のiPS細胞が残れば、ヒトに移植した後に奇形腫を生じる可能性があったが、その後の研究成果により克服されたようだ。 目の障害はいろいろで、水晶体が加齢とともに白濁して視力が低下する白内障や、網膜剥離や網膜色素変性などの網膜の機能がいったん損なわれると、視力が大幅に低下し、失明にも繋がる。 視細胞は元に戻ることはないため、これまでは有効な治療法がないとされてきた。しかし、どんな細胞にもなれる可能性を持った万能細胞・iPS細胞により、視細胞や網膜神経部のすぐ外側にある色素上皮細胞を作って移植すれば、網膜機能は再生すると考えられてきた。iPS細胞から網膜の病気の治療に必要な網膜細胞や網膜色素上皮細胞を多量に得る方法を確立すること、そして、これらの細胞を移植して、神経回路が回復するよう誘導する研究がされている。 加齢黄斑変性は、先進国において高齢者の主な失明原因となる疾患の一つで、欧米では成人の失明原因の第1位で、日本でも第4位となっている。黄斑とは、眼の網膜中心部にある、やや黄色みを帯びている丸い部分で、色の識別能力および視覚感度が特に高い。それに傷害などの変性が生じると、視界のゆがみや視力障害が起こる病気である。日本人では滲出型(しんしゅつがた)と呼ばれるタイプが多く、50歳以上の滲出型加齢黄斑変性の有病率は、約1.2%とも言う。その発症には、加齢はもとより、食生活・喫煙習慣・光刺激・遺伝的要因など様々な因子が関わっている。 網膜色素上皮細胞(RPE)は網膜の外側に位置するシート状の単層細胞層で、網膜の視細胞(網膜細胞)を維持するために重要な働きをしている。 滲出型加齢黄斑変性では、加齢などに伴う機能低下により、網膜色素上皮細胞の下にある、血管が豊富な脈絡膜から異常な脈絡膜新生血管が生じ、この新生血管が網膜色素上皮の下、もしくは網膜と網膜色素上皮の間に侵入して網膜を傷害することで発症する。新生血管は正常な血管とは異なり、血管から血液成分が漏れ出たり、血管が破れたりすることがある。このために、網膜が腫れたり、網膜の下に液体が溜まったりすることで、網膜が正常に機能しなくなる。 症状は、網膜が腫れる「網膜浮腫」や、網膜の下に液体が溜まる「漿液性網膜剥離(しょうえきせいもうまくはくり)が起こり、網膜自体がゆがむことで見る物がゆがんで見える変視症となることがある。多くの場合、最初に現れる症状はこの視界のゆがみで、進行すると、視界の中心が見えなくなる「中心暗点」や、色を識別しにくくなる症状が現れる。 現在、加齢黄斑変性では新生血管を抑制することを目的とした抗VEGF(“ブイイージーエフ” と呼ばれることが多い)製剤を、水晶体の奥にある硝子体腔に定期的に注射する治療方法が一般的である。しかし、この治療は効果の持続期間が短くしばしば再発するため、長年にわたり頻繁な治療を必要とする症例が多い状況である。 抗VEGFとは、「加齢黄斑変性の原因である脈絡膜の新生血管が、体内の血管内皮増殖因子(VEGF)の働きによって活発に成長する。抗VEGF製剤は、VEGFの作用を中和する抗体を薬剤化したもので、眼内注射することで脈絡膜新生血管の成長を抑えることができる。VEGFはVascular Endothelial Growth Factorの略、血管の= vascular、内皮の=endothelial意味である。 2014年9月12日、理化学研究所で世界最初の試みである、「滲出型加齢黄斑変性に対する自家iPS細胞由来網膜色素上皮(RPE)シート」を被験者眼球(片目)の網膜下に移植するのに成功した、と発表した。 その自家iPS細胞は、患者の皮膚から採取し培養した線維芽細胞に、京都大学iPS細胞研究所から提供されたエピゾーマルベクターを用いて、5因子(GLIS1、L-MYC、SOX2、KLF4、OCT3/4)を導入して作製し、 1例目の患者からは3株、2例目の患者からは1株、本研究プロトコルprotocol(実験・治療の実施要綱)で定めた規格を満たすiPS細胞株を樹立し、いずれのiPS細胞からもiPS-RPE(iPS細胞由来網膜色素上皮)を分化誘導することに成功した。 2017年1月11日、「iPS細胞由来の網膜組織を用いた視機能の回復」に関する報道発表資料によれば、 「網膜は再生力が低いため、障害を受けると自然な治癒は見込めません。網膜変性は加齢や遺伝的要因により、視細胞が変性し消失していく疾患です。視細胞がほぼ消失している末期の網膜変性には、現在のところ人工物を用いる人工網膜以外には確立した治療法はありません。そのため世界中で、成体幹細胞、ES細胞、iPS細胞由来の網膜組織を変性網膜に移植する試みが盛んに行われています。しかし、移植された網膜組織が成熟して光応答し、さらにシナプスが形成されたことを確認した報告はまだありません。 理研の研究チームは2014年に、マウスのES細胞やiPS細胞から自己組織化により分化させた立体網膜組織を網膜変性末期マウスの網膜に移植し、移植片中の視細胞が外節構造を持つ最終形態まで熟成することを示しました。」とある。 シナプスsynapseとは、神経細胞が別の神経細胞や筋細胞・腺細胞に情報伝達する特殊な結合である。通常、その間のシグナル伝達は、神経細胞から分泌される神経伝達物質neurotransmitterを介している。 殆どのシナプスは、情報を伝達する細胞(シナプス前細胞)の膜と、情報を受け取る細胞(シナプス後細胞)の膜との20nm(nanometre)ほどの狭い間隙で隔てられている。この間隙を越えて情報を伝えるために、電気シグナルが、神経伝達物質と呼ばれる小型のシグナル分子(化学シグナル)に変換されて分泌される必要がある。その神経伝達物質は、最初は神経末端部分にある膜に包まれたシナプル小胞内に蓄えられる。活動電位が神経末端に到達すると、一部のシナプス小胞は細胞膜と融合して、神経伝達物質が神経末端から放出される。放出された神経伝達物質は、シナプス間隙に速やかに拡散する。標的細胞のシナプス後膜に集まっている神経伝達物質受容体に結合すると、標的細胞の膜電位が変化し、これが十分大きければ活動電位発生の引き金となる。 2016年4月26日、理化学研究所の「シナプス強度の調節機構を発見」に「脳内では数千億個の神経細胞が複雑な神経ネットワークを形成しています。神経細胞同士がつながっている部分はシナプスと呼ばれ、このシナプスを介して1つの神経細胞から次の神経細胞へと情報が伝わります。シナプスが使われる頻度によって、シナプス強度(情報の伝わりやすさ)が変化し、学習や記憶が可能になるとされています。1つの神経細胞には平均数万個ものシナプスがありますが、個々のシナプスはそれぞれの情報の入力に応じて独立に強度変化を示すと考えられてきました。ところが近年、情報の入力があったシナプス(ホモシナプス)の近傍の入力のないシナプス(ヘテロシナプス)でも、シナプス強度の変化が起こる現象が報告され、同一神経細胞内の異なるシナプス間で相互作用が生じる可能性が指摘されていました。しかし、そのような相互作用を支えるメカニズムは分かっていませんでした」とある。 網膜領域に関しては、ヒトiPS細胞から網膜色素上皮細胞を分化誘導することに既に成功しており、角膜領域に関しても、これまでにヒトiPS細胞から重層上皮細胞の分化誘導と細胞シートの作製および角膜内皮様細胞の分化誘導に成功している。今後の課題は、ヒトiPS細胞由来の角膜上皮・内皮細胞シートの効果について、動物を用いた安全性の評価を確認中と言う。 2017年3月16日、「理化学研究所 多細胞システム形成研究センター」は、「手術より2年以上経過した現在においても腫瘍形成や拒絶は認められず、視力も維持、新生血管の再発もなく、追加の抗VEGF製剤の眼内注射は行っていません」と「安全性検証のための臨床研究結果を論文発表」に記した。 他人の人工多能性幹細胞(iPS細胞)から作った細胞を移植した際に起きる恐れがある拒絶反応の一つを、遺伝子操作を利用して回避することに試験管内の実験で成功したと、京都大の河本宏教授らの研究室が2017年8月24日付の米科学誌電子版に発表した。 他人の細胞から作ったiPS細胞を備蓄し、研究機関に広く迅速に提供する京大iPS細胞研究所のストック事業に役立つ可能性があるという。 再生医療を受ける患者本人の細胞からiPS細胞を作ると、拒絶反応は起きないが、準備に時間がかかり費用もかさむ。そのため、他人のiPS細胞を備蓄して必要なときに供給する体制づくりが進んでいる。 現在はタンパク質HLA(Human Leukocyte Antigen=ヒト白血球抗原)のタイプを調べ、拒絶反応を起こしにくい人から細胞の提供を受けている(leukocyte=lúːkəsὰɪt=白血球, Antigen=抗原)。 外来または非自己組織の拒絶に関与する遺伝子領域を主要組織適合遺伝子複合体major histocompatibility comlex(MHC)と呼ぶ。ヒトのその遺伝子領域は、HLAと名付けられた。HLAは、核のないヒトの赤血球を除くほぼ全ての細胞と体液に含まれ、自 己と非自己の識別に関与する重要な免疫機構として働いている。それぞれが数10種類の異なるタイプをもち、父母それぞれから受け継いだ遺伝子座の一対の組み合わせは数万にも及ぶ。そのHLAにより作られた抗体は、自分とだけ結合して反応する抗原を標的にし無力化する。 (かつての恐竜も含めて鳥類・魚類・爬虫類・両生類の赤血球にはすべて核があり、赤血球に核がないのは、ヒトを含めて哺乳類だけである。核をなくすことで、その分、細胞内に酸素と結合するヘモグロビンの量をより多く含むことができ、その赤血球を円盤状にすることで、体積当りの表面積を大きくし、効率的なガス交換が行える、 また、円盤状であることにより、微細な毛細血管でも通過ができるようになる、などの利点がある。histocompatibility =組織適合性) 免疫細胞は、数万にも及ぶHLAを目印に、自分の細胞と異物を見分けている。白血球の血液型であるHLA遺伝子が、父方由来と母方由来の2セットについて同一(HLA-ホモ)である人からiPS細胞を作製すると、片方だけ同じセットを持つ人(HLA-ヘテロ)に再生した組織を移植した場合に、拒絶反応が起こりにくいと期待されている。しかし、その場合でも、免疫系による拒絶反応を完全に回避するのは難しいと見られている。 河本宏教授らの研究室が、NK(ナチュラルキラー)細胞と呼ぶリンパ球が起こしうる免疫反応について調べ、NK細胞は、HLAの中のHLA-Cという分子を出していない細胞を殺傷するという特性を持っており、HLA-Cは、HLA-C1型と、HLA-C2型の2型に分けられる、と言う。 NK細胞は、体内全身をパトロールしながら、がん細胞やウイルス感染細胞などを見つけて攻撃するリンパ球である。防衛機構である自然免疫に重要な役割を担う。NK細胞は血液中に存在するリンパ球の10~30%を占め、細胞膜に孔を開けるタンパク質や、標的細胞に細胞死を誘導する一群のセリンプロテアーゼなどの細胞傷害因子を持っている。 血管の細胞のHLAに「C1」と「C2」という遺伝子が含まれると、NK細胞は異物とみなさないことがわかった。C1だけだとNK細胞は攻撃したが、iPS細胞にC1、C2の両方を組み込むと、拒絶反応を回避できた。 他人のiPS細胞から血液の細胞を作り、HLA型が半分同じ人のNK細胞と一緒に試験管に入れたところ、拒絶反応が起きた。特定HLA型が100%同じになるように、他人のiPS細胞の遺伝子を組み換えると、拒絶反応の一つが起きなくなった。 iPS細胞の形成に期待されているのは、iPS細胞から様々に分化した細胞・組織・器官を作り出す再生医療に応用できる多くの可能性を秘めているからだ。iPS細胞の成功が契機となり、分化細胞を作るための別の取り組みが行われている。例えば線維芽細胞からiPS細胞を経由せずに、新たに分化細胞を作る試みである。 発生・分化の過程で、細胞を機能と形態を含めて一定方向に導くマスター遺伝子が存在する。ある細胞が特定の細胞種へと分化するための指令スイッチとして機能する遺伝子で、マスター遺伝子が欠損すると細胞分化が起こらなくなり、逆にマスター遺伝子を強制的に発現させることによって、本来、起こりえないはずの細胞分化を誘発する。 例えば、ショウジョウバエで、眼を作る方向への指示に働くeyeless (ey)遺伝子を、脚の細胞に敢えて働かせると、脚の細胞が眼の器官として分化を始める。結果、脚の部分に眼ができる。マスター遺伝子は、ノックアウトマウスknockout mouse(1個以上の遺伝子が無効化された遺伝子組換え実験用のマウスである。マウスの特定の遺伝子を不活性化にして、正常のマウスとの行動や状態を比較することで、研究者は失われた遺伝子の機能を推定する)による発生・分化の研究によって、様々な器官と組織において、様々な種類が存在していることが明らかになった。 過去に1880年代から、マスター遺伝子と関連する遺伝子を線維芽細胞に移植することで、別種類の分化細胞に直接転換させる試みが、細々と始まっていた。ところが山中教授の研究室のiPS細胞の成功が契機となり、新たな発想に繋がり急展開し、iPS細胞までの未分化な状態に戻すことなく、目的の分化細胞に直接転換させる試みが始まり、直接の再プログラミングを図る研究が本格的に行われた。それにより、2010年~2011年かけて、筋肉・心筋・血球・神経・肝臓などの様々な細胞への転換に成功した。 万能細胞のiPS細胞を経由せずに、分化細胞を直接再プログラミングした方が、短時間で目的細胞が得られる。新たな分化細胞が得られる方法が確立されたようだ。 発生・分化の過程で、細胞を形態と機能の両方を導くマスター遺伝子の存在が知られた。マスター遺伝子は、ある細胞が特定の細胞種へと分化するための指令スイッチとして機能する遺伝子で、マスター遺伝子が欠損すると細胞分化が起こらなくなり、逆にマスター遺伝子を強制的に発現させることによって、本来、起こりえないはずの細胞分化が誘発される。例えば、動物では、やはりbHLH転写因子をコード化するMyoDは筋細胞分化のマスター遺伝子であり、MyoDを強制的に発現させることにより、あらゆる細胞を骨格筋に変換させる。 少数の転写調節因子が、遺伝子群全体の発現を制御し、細胞の型さえ変える。転写調節の威力が、モデル生物として研究されるショウジョウバエの目の発生過程の研究が知られている。Eyと名付けられたマスター転写調節因子1個に誘発され、単なる1種類の細胞が作られるどころか、目の器官全体が出来上がった。実験室で、ショウジョウバエの本来ならば脚になるはずの細胞の胚に、あえてEy遺伝子を発現さえると、この胚から成体となったハエの中に、脚の真ん中に目を持つものが出てきた。Eyが調節する遺伝子の中には、別の遺伝子の発現を調節する転写調節因子である遺伝子も含まれているため、たった1個の転写調節因子の働きで、その他の転写調節因子にスイッチが入り、次々と連鎖が起こり、目にある様々な細胞群の分化を協調させ、目の器官全体としての三次元構造体を作り上げた。この原理が繰り返して応用され、複雑な生物の成体が、胚から順次作り上げられる過程が想像できるようになった。 一度ある特定の型へ分化した細胞は、その後もその分化状態を維持するのが通例なので、子孫細胞も同じ型になる。高度に専門化した細胞には、骨格筋細胞やニューロンのように、一度分化すると二度と分裂しなくなる。即ち最終分化するのである。 線維芽細胞や肝細胞、眼球の中の毛様体筋や虹彩筋と胃や腸などの内臓筋に見られる平滑筋細胞などは、分化後も個体の一生を通じて何度も分裂を繰り返すものが多い。しかも、分裂しても自分と同じ細胞しか生み出さない。 細胞が増殖しながらも独自の型を保つ細胞記憶cell memoryがあるということは、その独自性を生み出す遺伝子発現パターンを記憶し、その後の細胞分裂の際に、娘細胞に必ず受け継がれることを意味する。それは一度始まった各々の細胞の転写調節因子の生産は、細胞分裂のたびごとに娘細胞に受け継がれる永続性の仕組みがあるからだ。 自分はどうという細胞なのか娘細胞に確実に記憶させる方法は、いくつかあり、その最も簡単で重要なのが、正のフィードバックループpositive feedback loopである。その独自性をもたらす遺伝子発現パターンが、その後の細胞分裂の際には必ず娘細胞に受け継がれ、一度、始まった各々の転写調節因子の生産は、それ以降の娘細胞の分裂の度に、永続して娘細胞に引き継がれる。その鍵となる転写調節因子が、細胞の型に特異な遺伝子と共に、自分自身の遺伝子の転写をも活性化させる仕組みも維持される。その鍵となるマスター転写調節因子は、自身の転写に伴い、その細胞の種類に応じた特異的遺伝子の転写をも活性化させる。そのため子孫細胞はすべて、元の細胞の一過性のシグナルを受け取って、このマスター転写調節因子の生産をする。それ以降の娘細胞は、それを記憶する。細胞分裂のたびに調節因子は娘細胞に分け与えられ、そこで正のフィードバックループの刺激を続ける。その刺激が続くために、それ以降の世代細胞は、必ず調節因子を作り続ける。Eyタンパクが、この正のフィードバックループを作っている。正のフィードバックは、自己維持的な遺伝子発現回路を築くのに不可欠な仕組みである。細胞に特定の運命を与え、その情報が永続的に子孫へ継承されるのは、この回路のおかげである。 目次へ |
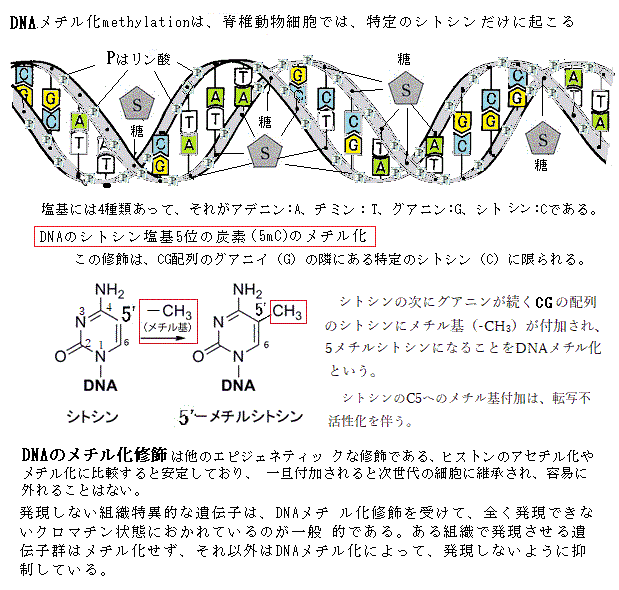
11)DNAメチル化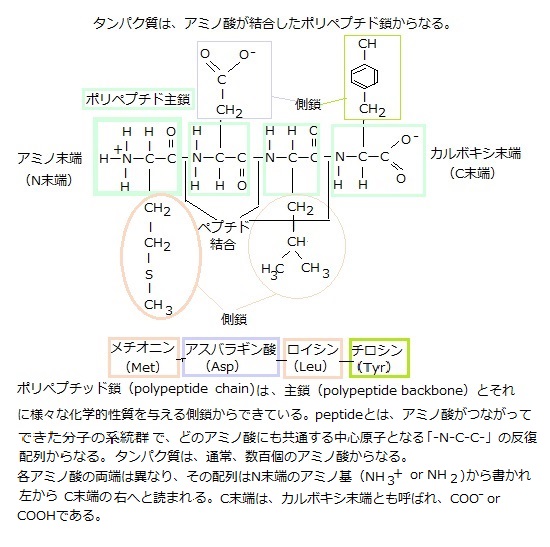 自分がどういう種類の細胞になる運命なのかを、娘細胞に記憶させる方法で、最も一般的なのが、「正のフィードバックループ」であるが、細胞の自己認識を強化する方法は他にもあり、その1つが共有結合性修飾のDNAメチル化である。 脊椎動物細胞では、メチル化は、特定のシトシンだけに起こり、遺伝子の転写を妨げるタンパク質が、メチル化シントンに引き寄せられるため、普通は遺伝子がオフになる。 DNAメチルのパターンは、娘DNA鎖の合成直後に親DNA鎖のメチル化パターンを写し取る酵素が働くため子孫細胞へと受け継がれる。 細胞分裂では、DNAのメチル化パターンが正確に受け継がれていく。DNAのメチル化パターンが一度出来上がると、メチル基転移酵素と呼ばれる酵素の働きで、そのパターンが確実に新生DNAに受け継がれる。複製直後の娘二重らせんには、メチル化されたDNA鎖(親二重らせんから引き継いだ鎖)と新しく合成されたメチル化されていないDNA鎖が1ほんずつ含まれる。メチル基転移酵素は、この混成らせんに結合し、メチル化されているCG配列と対合したCG配列だけをメチル化する。 内部細胞塊とその表面を覆うトロフォブラストは、やがて胎盤を構成する主要細胞に分化し、ホルモン分泌や栄養・ガス交換に働く合胞体トロフォブラストや、子宮内で母体の血管の再構築を担う絨毛外トロフォブラストといった細胞へ分化する。 内部細胞塊は、内胚葉・中胚葉・外胚葉の3方向に大きく分化する。それぞれは、分化できる可能性の幅の広い多能性幹細胞から、次第に特定の細胞群にしか分化できない多能性幹細胞群に分化し始める。最終的には、肝細胞や神経細胞と言った終末分化細胞になる。その発生と分化が「エピジェネティックな遺伝子発現プログラムの進行である」。 エピジェネティックな遺伝子発現の調節は、発生・分化の過程だけで、その役割を終えるのではない。発生のある段階で固定され、特定の分化細胞として、あるいは幹細胞として、その後の一生を通じてエピジェネティックな遺伝子発現の調節は機能し続ける。更に、その後の生活の過程で、様々なエピジェネティックな変化が積み重なる。エピジェネティックな遺伝子発現調節は、一生関わる生体変化である。 受精卵から孵化(出産)に至る間の胚を取り囲む環境が、エピジェネティックな変化を誘い、実際の研究においても、それが原因として「エピネジェネティックな異常」が起こり、成人病や癌などの様々な病気を生み出すことが分かってきた。 各々の細胞が、自分がどう言う種類の細胞を継承するのかを、自己認識する最も一般的な正のフイードバックループは、その細胞が自己認識を強化する方法であり、それは共有結合性修飾のDNAメチル化と呼ばれる。脊椎動物細胞のメチル化では、特定のシトシンだけに起こり、遺伝子の転写を妨げるタンパク質が、メチル化シトシンに引き寄せられるため、通常は特定の遺伝子がオフになる。そのDNAメチル化のパターンが、娘DNA鎖の合成直後に親DNA鎖のメチル化パターンを写し取る酵素が働くため、子孫細胞に受け継がれる仕組みが形成される。細胞分裂では、親細胞のDNAメチル化パターンが、一度、形成されていると、それが正確に受け継がれて行く。 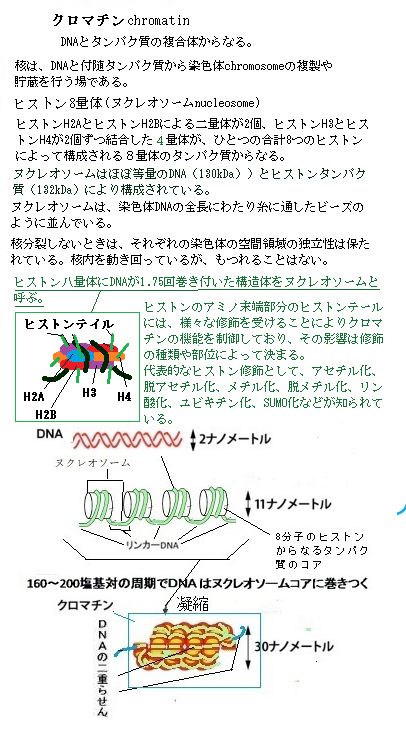 遺伝子の発現パターンを受け継ぐためのもう一つの仕組みが、ヒストンの修飾である。細胞がDNAを複製する際に、親染色体と共有結合修飾しているヒストンタンパク質が、半分ずつ、それぞれの娘DNAらせんに引き継がれる。ヒストンを修飾する酵素が、この親由来のヒストンに結合して、周囲の新しいヒストンに同じ修飾を行い、この修飾が繰り返され、親染色体に見合ったクロマチン構造が受け継がれていく。 遺伝子の発現パターンを受け継ぐためのもう一つの仕組みが、ヒストンの修飾である。細胞がDNAを複製する際に、親染色体と共有結合修飾しているヒストンタンパク質が、半分ずつ、それぞれの娘DNAらせんに引き継がれる。ヒストンを修飾する酵素が、この親由来のヒストンに結合して、周囲の新しいヒストンに同じ修飾を行い、この修飾が繰り返され、親染色体に見合ったクロマチン構造が受け継がれていく。 メチル基転移酵素と呼ばれるタンパク質の働きで、そのパターンが確実に真正DNAに受け継がれる。複製直後の娘二重らせんには、メチル化されたDNA鎖には、親二重らせんを引き継いだメチル化された鎖と、新しく合成されたばかりで、メチル化されていないDNA鎖が一本ずつ存在する。メチル基転移酵素は、この混成らせんに結合して、既にメチル化されているCG配列に対合する、まだメチル化されていないDNA鎖の方のCG配列だけをメチル化する。 DNAのメチル化は、DNAの塩基に起こる修飾であり、その変化を認識して多くの種類のタンパク質がそこに結合して、遺伝子の働きを制御する。DNAに直接関わる変化であるが、DNAの塩基配列(遺伝子の暗号)の移動が伴わないため、エピジェネティックな変化に属する。 肝細胞では、発生・分化の過程で、神経や筋肉などの固有の分化機能が、不可逆的かつ完璧に制御される。これは抑制される遺伝子のメチル化により、このDNAのメチル化というエピジェネティック制御の状態は、親の肝細胞から子孫の肝細胞に引き継がれる。 遺伝子の発現パターンを受け付け継ぐためのもう一つの仕組みは、ヒストンの修飾である。ヒストン修飾は、娘染色体に受け継がれる。細胞がDNAを複製する際に、親染色体と共有結合修飾をしていたヒストンタンパク質が半分ずつ、それぞれの娘DNAらせんに引き継がれる。染色体が複製される際に、結合したヒストンは2本の娘DNAらせんにランダムに分配されている。そのため、娘染色体は、親の修飾ヒストンの半分を受け継ぎ、残りのDNAの部分は、新しく合成される。その仕組みは、未だ修飾されていないヒストンが結合すると、各種の修飾酵素それぞれが、自身が作るのと同じ修飾に結合すると、それが触媒となって、新しいヒストンに同じ種類の修飾を行う。このような修飾と認識の連鎖により、ヒストンを修飾する酵素が、この親由来のヒストンに結合して、それが触媒となって、周囲の新しいヒストンに同じ種類の修飾を行い、この修飾の繰り返しで、親の修飾パターンが維持され、親染色体に見合ったクロマチン構造が娘染色体に受け継がれる。 遺伝子を構成するDNAの塩基配列は、遺伝子暗号(遺伝子コード)と呼ばれるが、その塩基配列を変えることがない、DNAの特定部位のヒストンタンパク質の特定な修飾状態は、エピジェネティックな特性を親細胞から娘細胞へ伝える暗号としてとらえヒストンコードと呼ばれている。しかしながら、この仕組みは、一部のヒストン修飾にあてはまっても、すべてに通用するわけではない。DNAのメチル化とヒストンコードを合わせて、「エピジェネティックコード」とも呼ばれる。遺伝子コードは、塩基配列だけに書かれているのではないようだ。他種のタンパク質と塩基配列の複合的な領域にも秘められていると見られる。 DNAは、ヒストンと言うタンパク質と密に結合することにより、クロマチンと称するひも状の繊維を作って密着し、核の中に納まっている。強いマイナス電荷のDNAとプラス電荷のヒストンが強固に結合している。他方、原核生物(細菌と藍藻類)のDNAは、全くの裸ではないが、ヒストンがないためクロマチン構造になっていない。 以上の細胞記憶の仕組みは、DNAの塩基配列を変えることなく、親細胞から娘細胞へ遺伝子発現パターンを伝えるので、エピジェネティックな遺伝epigenetic inheritanceと言える。これらのエピジェネティックな変化は、遺伝子発現パターンの制御に重要な働きとなって、殆どの細胞は、環境からの一過性のシグナルを、細胞記憶として永久に子孫に伝えていく。その記録は、細胞が細菌やウイルスに侵された際に、どのような機能不全を起こすかを研究することで、細胞内のタンパク質の仕組みと機能が解析される。しかも、エピジェネティックな変化には、様々な機構が相乗的に関わって来る。 真核生物のDNAを構成する1つのヌクレオソームは、4種類ある8つのヒストンタンパク質が集合したもので、その集合に際しては、一定の仕組みと順番があり、ヒストンの集合に際しては、ヒストンシャベロンと言う介添え役のタンパク質の助けによって結合する。 同一個体の細胞が持っている遺伝子のセットは、リンパ球を除く全ての細胞は、同じ遺伝子を持っている。受精卵から成体の体細胞まで同じである。それが、個体の発生後の成長に伴い、環境変化やそれに呼応する遺伝子の発現と働きなどの前提条件により、以後の遺伝子の発現が様々に変化し、それぞれの個体を特有なものにして行く。 目次へ |
| 12)リンパ球 リンパ球は独自性が強く、常に遺伝子の組み換えにより、新しい遺伝子を作り、それを発現させている。遺伝の組み換えが起きる例は、真核生物では頻繁に広く観察される。DNAの塩基配列が変化すると、関連する遺伝子の発現も変化する。遺伝子が大きく変化することにより、遺伝子の発現が変化し、あるいは遺伝子の働きが調節される。 抗体antibodyと呼ばれるタンパク質をコード化する遺伝子から、抗体タンパク質を生成する。動物や一部の植物は、自己特有の物質を持つ細胞と、その生体内にありながら、非自己を持つ細胞を、本来あり得ないものとして区別している。特に哺乳類では、この識別能力が発達し、これを「免疫反応」と言う。「免疫反応」では、非自己であるウイルスや病原菌などの抗原antigenが体内に進入した時、抗体と言うタンパク質を作って、これを抗原に結合させて無力化する抗原―抗体反応を行う。 生体内でのタンパク質の性質は、ほかの分子との物理的相互作用で決まる。抗体は、ウイルスや細菌と結合して生体防御の一部となる。結合の強さにかかわらず、タンパク質の他の分子への結合は、必ず高い特異性を示す。そのため、あるタンパク質が出合う数千もの分子のうち、結合対象になり得るものは、1つかせいぜい数個に過ぎない。 タンパク質が結合する物質は、イオン・有機小分子・巨大分子と豊富で範囲も広い、それらをタンパク質のリガンドligandと呼ぶ。ラテン語で結合を意味するligareを語源とする。 タンパク質の機能には、特定のリガンドとの結合が不可欠である。抗体は、標的となる抗原を、先端の抗原結合部位でしっかりと捕らえるタンパク質であり、ヒトの体には、考え得るどんな分子をも識別して、確実に結合する膨大な種類の抗体分子を生産する能力を潜めている。タンパク質の内部に埋め込まれている原子は、リガンドとは直接接触はしないが、その骨組みとなる分子の表面の形状が、その化学的性質を決める。抗体との接触により、抗原の分子内部のアミノ酸に僅かな変化が生じても、三次元構造が変化して、抗原のタンパク質固有の機能が失われる。 免疫グロブリン遺伝子は、抗原抗体反応に関与する免疫グロブリンimmunoglobulin(抗体; immunoは免疫の意味)をコードする遺伝子群の総称である。リンパ球という細胞は、実に大きなグループで、生体を防御する重要な細胞であるが、大きく分けて、骨髄幹細胞が分化したリンパ細胞で、免疫グロブリンを分泌するB細胞 (Bリンパ球) と、骨髄で生成されたリンパ球が胸腺(胸骨の裏側、心臓の上前部にある臓器)に移送されて成熟するT細胞 (Tリンパ球) とがある。移植免疫などでは、T細胞グループが関係してくる。 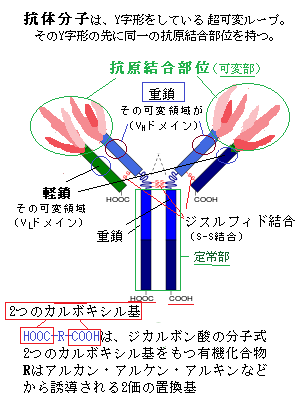 抗体を産生するリンパ球B細胞は、骨髄(Bone marrow)中の造血幹細胞から派生し、造血多能性前駆細胞として産生され、末梢の血液中や組織液中で免疫グロブリンとして分化し成熟する。それ故B細胞と呼ばれる。その際に、抗体の遺伝子・免疫グロブリン遺伝子に組換えが起こり、可変領域の先端にある抗原結合部位Antigen
binding siteに膨大なレパートリーが作られる。この現象は「遺伝子再編成」と呼ばれている。分化の過程で免疫グロブリン遺伝子の再構成を行い、成熟した一つのB細胞は、発現可能な一つの免疫グロブリン遺伝子を持つようになり、その遺伝子に基づいた抗原受容体として働くB細胞受容体を発現する。ある抗原が体内に侵入してくると、B細胞は、同一の抗原特異性をもつヘルパーT細胞、もしくは直接抗原により活性化され、B細胞は終末分化してプラズマ細胞plasma
cell(形質細胞)へと変化し、免疫グロブリンの合成と分泌に特化した細胞として抗体を産生・分泌するようになる。免疫応答により体内から抗原が排除されると、プラズマ細胞は、メモリーB細胞となり、次に抗原が体内に侵入してきたときに速やかに免疫応答を起こすために備える。リンパ球B細胞の発生分化後に再編成を起こし、異なるアミノ酸配列の可変領域を持つB細胞が現れ、それぞれの抗原特異性に対応する多様性が生じる。 抗体を産生するリンパ球B細胞は、骨髄(Bone marrow)中の造血幹細胞から派生し、造血多能性前駆細胞として産生され、末梢の血液中や組織液中で免疫グロブリンとして分化し成熟する。それ故B細胞と呼ばれる。その際に、抗体の遺伝子・免疫グロブリン遺伝子に組換えが起こり、可変領域の先端にある抗原結合部位Antigen
binding siteに膨大なレパートリーが作られる。この現象は「遺伝子再編成」と呼ばれている。分化の過程で免疫グロブリン遺伝子の再構成を行い、成熟した一つのB細胞は、発現可能な一つの免疫グロブリン遺伝子を持つようになり、その遺伝子に基づいた抗原受容体として働くB細胞受容体を発現する。ある抗原が体内に侵入してくると、B細胞は、同一の抗原特異性をもつヘルパーT細胞、もしくは直接抗原により活性化され、B細胞は終末分化してプラズマ細胞plasma
cell(形質細胞)へと変化し、免疫グロブリンの合成と分泌に特化した細胞として抗体を産生・分泌するようになる。免疫応答により体内から抗原が排除されると、プラズマ細胞は、メモリーB細胞となり、次に抗原が体内に侵入してきたときに速やかに免疫応答を起こすために備える。リンパ球B細胞の発生分化後に再編成を起こし、異なるアミノ酸配列の可変領域を持つB細胞が現れ、それぞれの抗原特異性に対応する多様性が生じる。遺伝子レベルで組み合わせを変化させることにより、限られた数の遺伝子から無数の抗原に対する免疫グロブリン(抗体)を作り出すことができる。 抗体はY字形をした分子で、同一の抗原結合部位を2個以上持ち、それぞれの抗原分子表面の小さな部分と相補的な形をとる。抗体のY字形の領域は、可変なアミノ酸配列であるが、抗体ごとに大きく異なっている。その部分の抗体分子は、抗原結合部分の半分を占める可変領域で、その端からループ状に伸びるポリペプチド鎖は、抗原と結合する超可変なループ領域となっている。このタンパク質を形成する4本のポリペプチド鎖は、同一の重鎖2本と同一の軽鎖2本からなり、それぞれ110のアミノ酸が単位となり、それらが硫黄原子間の結合(硫黄の原子記号はŞ)によるジスルフィド結合disulfide bond(S-S結合とも言う。硫黄が-S-S-のように結合した構造を持つ化合物で、タンパク質もこの結合で特有の立体構造を作る)で連結している。この構造単位をドメイン(領域)と呼ぶ。それらの重鎖の可変領域(VHドメイン)と軽鎖の可変領域(VL)が近接して抗原結合部位を形成している。このループのアミノ酸配列は変化に富んでいるが、抗体の基本構造を変えず、ループの長さとアミノ酸配列を変えるだけで、膨大な数の結合部位が形成され、これにより多種多様な抗体を生産する。 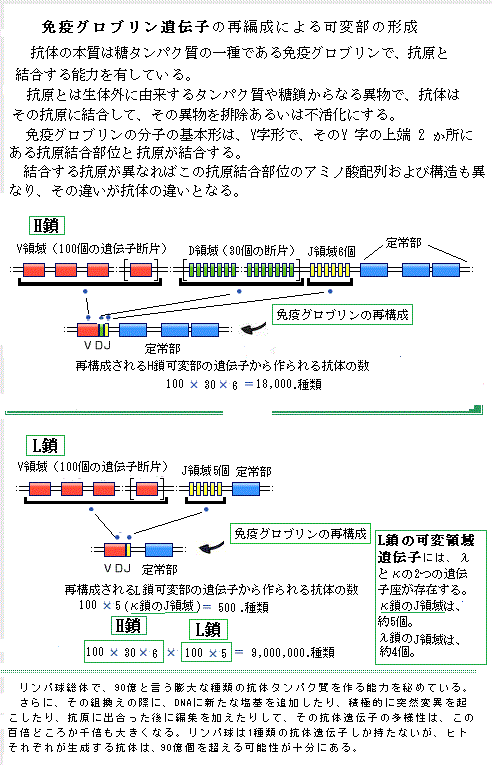 抗体は白血球の一種のB細胞(Bリンパ球)が作る。休止状態のB細胞の表面膜には、特定の抗原を識別して受容体として働く抗体分子が含まれている。一度、抗原がその受容体に結合すると、B細胞は活性化し分裂を開始する。特性が同じ水溶性の抗体を大量に分泌する。 抗体は白血球の一種のB細胞(Bリンパ球)が作る。休止状態のB細胞の表面膜には、特定の抗原を識別して受容体として働く抗体分子が含まれている。一度、抗原がその受容体に結合すると、B細胞は活性化し分裂を開始する。特性が同じ水溶性の抗体を大量に分泌する。タンパク質には親水性の領域と疎水性の領域があるが、親水性領域の方は水溶性が高く抗体に適している。膜タンパクの細胞膜表面に露出した領域は親水性で、構造的に柔軟性が高い。 インフルエンザに感染した際、これを非自己と認識して対抗する反応を起こすのも抗原―抗体反応であるが、花粉症や食物アレルギーも抗原―抗体反応である。違う血液型を輸血できないのも、臓器移植が難しいのも非自己を排除するからで、ヒトは何億種類もの抗原に対応する抗体を作る能力がある。抗体はタンパク質であるから、抗体を作るのための遺伝子のコードが必要だ。つまり、ヒトは何億もの抗体遺伝子を持つことになる。ヒトの遺伝子は総体で26,000位しかない。しかも抗体を作る細胞は、リンパ球だけで、1つのリンパ球は1種類の抗体しか作れない。 ところが、リンパ球と言う細胞の実体は、膨大な細胞グループで、体内を流れる抗体は、主にBリンパ球と呼ばれるグループを作る。また移植免疫などには、Tリンパ球と言うグループが関係している。どちらのリンパ球も、自己と非自己を区別する反応に関わるが、その役割に違いがある。 Bリンパ球には、実に多くのグループがある。タンパク質として特徴は、大きな巨大分子からなるタンパク質(H鎖)と小さなタンパク質(L鎖)が2つずつ、合わせて4つが集まって、一つの抗体分子を形成する。4つのタンパク質のそれぞれに、VドメインとCドメインと名付けられた部位があり、そのそれぞれの末端にあるVドメイン部分のアミノ酸配列が何種類もある。これらが異なった抗原の、それぞれの構造を見分けて反応する。重要なのは、その何種類もの膨大な異なった構造を持つ抗体タンパク質分子をどう供給するかである。 一つのタンパク質が、機能的あるいは構造的に特徴づけられる、最も大きな単位として、ドメインを形成することが多い。それがどう言う二次構造を作るかは、アミノ酸配列による。 実は、リンパ球以外のすべての細胞は、抗体を作る遺伝子の前駆体と言える遺伝子を持っている。それはあくまでも前駆体であり、その細胞から抗体を作ることはできない。しかしリンパ球は、リンパ球として分化する過程で、前駆体遺伝子のDNA組み換えが生じ抗体遺伝子を作れるようになる。例えば、前駆体遺伝子のVの5番目、Dの2番目、Jの1番目を組み合わせて、H鎖のVドメイン部分を作る。同じく、VとJから適当な部分を選択して、L鎖のVドメイン部分を作る。それ以外の使われなかったV・D・L部分のDNAは、破棄され消化される。それで、1種類のリンパ球は、1種類の抗体遺伝子しか持っていないことになる。 DNAの切断と再結合による遺伝子の組み換えにより、H鎖で100×30×6、L鎖で100×5の相互組み合わせができる。H鎖とL鎖の組み合わせで抗原を認識することで、(100×30×6)×(100×5)=9,000,000.程度の異なる組み合わせが可能になり、リンパ球総体で、これだけの種類の抗体タンパク質ができる。 さらに、その組換えの際に、DNAに新たな塩基を追加したり、積極的に突然変異を起こしたり、抗原に出合った後に編集を加えたりして、その抗体遺伝子の多様性は、この百倍どころか千倍も大きくなる。リンパ球は1種類の抗体遺伝子しか持たないが、ヒトそれぞれが持つリンパ球自体、90億個を超える可能性を十分に秘めている。 ヒトは、進化の過程で、何億種類もの抗原に対応する抗体を作る潜在的な能力を十分備えてきたが、非自己であるウイルスや病原菌などの抗原の体内への侵入の際に、抗原-抗体反応が、完全的確に適宜に生じていないから病死する。それを速やかに生じさせる薬品ができれば、万病薬となるだろう。 目次へ |
13)エピジェネティックな修飾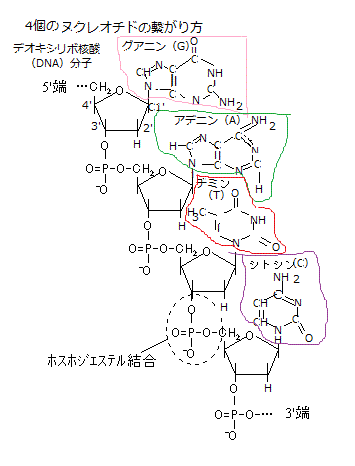 実は、エピジェネティックな修飾epigenetics modificationとは、個体発生に関する説の1つである「エピジェネシスepigenesis(後成説)」と、「ジェネティクスgenetics(遺伝学)」を起源としている。同じ遺伝的性質をもつ集団を、異なる環境におくと、その環境に適応して多様な形態を持つようになる。これをエピジェネシス(後成説)と呼ぶ。Nature(néɪtʃə)
は、遺伝的な形質を言うが、 nurture(nˈəːtʃə) は養育・教育など育った環境のよる後天的な特質を表わす。エビジェネシスは、環境や養育・教育などの影響により、潜在的に隠れていた遺伝的形質が発現すると説く。 実は、エピジェネティックな修飾epigenetics modificationとは、個体発生に関する説の1つである「エピジェネシスepigenesis(後成説)」と、「ジェネティクスgenetics(遺伝学)」を起源としている。同じ遺伝的性質をもつ集団を、異なる環境におくと、その環境に適応して多様な形態を持つようになる。これをエピジェネシス(後成説)と呼ぶ。Nature(néɪtʃə)
は、遺伝的な形質を言うが、 nurture(nˈəːtʃə) は養育・教育など育った環境のよる後天的な特質を表わす。エビジェネシスは、環境や養育・教育などの影響により、潜在的に隠れていた遺伝的形質が発現すると説く。Modification( mὰdəfɪkéɪʃən)は、 (部分的)変更・修正・緩和・調節・(部分的)改造・修飾・限定など多様な意味があり、実際、その多く作用を網羅している。 「エピジェネティクス」は「遺伝子の上に更に修飾が加わったもの」「さらに優位になったもの」などという意味を持つ。ジェネティクスでは、DNAを構成するA(アデニン)・T(チミン)・G(グアニン)・C(シトシン)という4種類の塩基の並び方、すなわち塩基配列を遺伝情報の基本とする。一方エピジェネティクスでは、DNAの塩基配列は変えずに、あとから加わった修飾が遺伝子の活性を決める。 タンパク質の設計図は、遺伝子DNAの塩基配列によりコード化されている(遺伝子コード)。遺伝子DNAに書かれたタンパク質の情報は、核内の核小体でリボソームタンパク質とrRANが会して大小のサブユニットを形成し、そのそれぞれが核膜孔を通って細胞質に運ばれ、そこでも再集合してかなり多数のリボソームを形成する。リボソーム内のmRNAに転写された後に、リボソームによってアミノ酸へと翻訳されタンパク質が重合される。この間、RNAポリメラーゼ(RNA polymerase)がRNAを合成する酵素として働き、DNA を鋳型として RNA を合成する転写反応を触媒する。 転写が始まるには、RNAポリメラーゼや他の結合タンパク質が、DNAに近付ける場合だけである。DNAに接近できるのは、ヒストンによるDNAの折り畳みが「ゆるめられる」必要があり、その過程は、DNAとヒストンによる化学的修飾による。その修飾も、遺伝子の塩基配列を変えずに遺伝子の働きを変えるため「エピジェネティックな修飾」と呼ばれる。DNA の低メチル化や活性化型ヒストン修飾の増加により、クロマチン構造が緩むと遺伝子発現が活性化される。 DNAの修飾は、シトシン残基のメチル化methylationである。哺乳動物では、4つの塩基の組み合わせの中で、シトシンの次にグアニンが続くCGの配列のシトシンにメチル基(-CH3)が付加され、5メチルシトシンになることをDNAメチル化という。哺乳類では3種類のDNAメチル化酵素と3種類のDNA脱メチル化酵素が見つかっている。 遺伝子の活性に影響するエピジェネティクスな修飾は、タンパク質ファミリーであるヒストンでも起こる。ゲノムDNAはヒストンというタンパク質に巻き付いた状態で核内に収納され、ともにヌクレオソームを構成する。この構造をクロマチンという。それぞれのヒストンには、ヒストンのコア領域に含まれないN末端・C末端側の領域に、ヒストンテイルhistonetailを持ち、それがヒストンのアミノ酸鎖の最初の部分を構成し、ヌクレオソームの外に出ている。ヒストンの修飾は、これらのテイルで起こる。これらの修飾は、ヌクレオソームの立体構造に影響し、それによってその領域の遺伝子の活性に影響する。 アセチル化・メチル化・リン酸化・モノユビキチン化など様々な翻訳後修飾を受けている、これらの修飾はクロマチン構造を変化させ、エピジェネティックな遺伝子発現制御に関わっていると考えられている。 目次へ |