| Top 車山高原 車山高原お知らせ 車山ブログ
|
 |
DNA DNAが遺伝物質 生物進化と光合成 葉緑素とATP 植物の葉の機能 植物の色素 葉緑体と光合成 花粉の形成と受精 ブドウ糖とデンプン 植物の運動力 光合成と光阻害 チラコイド反応 植物のエネルギー生産 ストロマ反応 植物の窒素化合物 屈性と傾性(偏差成長) タンパク質 遺伝子が作るタンパク質 遺伝子の発現(1) 遺伝子の発現(2) 遺伝子発現の仕組み リボソーム コルチゾール 生物個体の発生 染色体と遺伝 減数分裂と受精 対立遺伝子と点変異 疾患とSNP 癌変異の集積 癌細胞の転移 大腸癌 細胞の生命化学 イオン結合 酸と塩基 細胞内の炭素化合物 細胞の中の単量体 糖(sugar) 糖の機能 脂肪酸 生物エネルギー 細胞内の巨大分子 化学結合エネルギー 植物の生活環 シグナル伝達 キク科植物 陸上植物の誕生 植物の進化史 植物の水収支 拡散と浸透 細胞壁と膜の特性 種子植物 馴化と適応 根による水吸収 稲・生命体 胞子体の発生 花粉の形成 雌ずい群 花粉管の先端成長 自殖と他殖 フキノトウ アポミクシス 生物間相互作用 バラ科 ナシ属 蜜蜂 ブドウ科 イネ科植物 細胞化学 ファンデルワールス力 |
||||
|
1)イオン結合と電荷
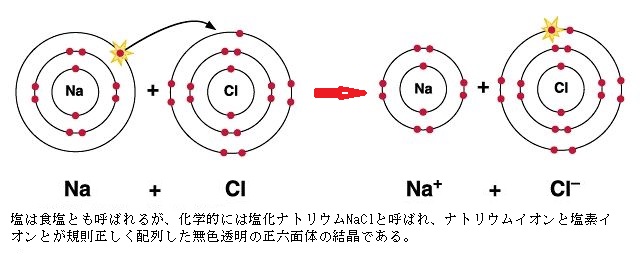 イオン結合(ionic bond)は、電子を共有結合するよりも、他の原子に電子を移すか、電子を受け取る方が、最外殻を満たしやすい原子間で形成される。ナトリウム(Na;原子番号11)原子は、最外殻にあたる第3電子殻に電子が1個あるだけであるから、その1個を放出できれば第2電子殻が最外殻になるので、最外殻が満たされる。塩素(Cl;chlorine)は、最外殻にあたる第3電子殻に電子が7個ある。電子を1個得られれば最外殻は満たされる。
イオン結合(ionic bond)は、電子を共有結合するよりも、他の原子に電子を移すか、電子を受け取る方が、最外殻を満たしやすい原子間で形成される。ナトリウム(Na;原子番号11)原子は、最外殻にあたる第3電子殻に電子が1個あるだけであるから、その1個を放出できれば第2電子殻が最外殻になるので、最外殻が満たされる。塩素(Cl;chlorine)は、最外殻にあたる第3電子殻に電子が7個ある。電子を1個得られれば最外殻は満たされる。Na原子がCl原子と出合うと、電子が1個Na原子からCl原子に飛び移り、双方の最外殻が満たされる。
ナトリウムは、非常に反応性の高い軟らかい金属で、日本の工業分野では、特に化合物中のナトリウム成分を曹達(ソーダ)と呼び、「毒物及び劇物取締法」により劇物に指定されている。それが緑色の有毒気体である塩素とイオン結合して、美しい無色透明な結晶となり塩化ナトリウム(NaCl)という化合物・塩ができる。それが、地球上の大半の生物にとって、生命維持に欠かせない重要な物質となる。
 Na原子からCl原子に電子が飛び移ると、互いの原子は電荷を帯びた2個のイオン(ion; άɪən)が生じる。マイナスの電子を1個失ったNa原子は、正電荷を持つ陽子より負電荷の電子が一個減るため、原子は1価の正電荷を持つ(Na+)。電子を1個余分に獲得したCl原子は、陽子より電子が1個多くなり、1価の負電荷を持つ(Cl-)。Na+とCl-は、反対の電荷を持つため静電引力で互いに引き合うようになる。
Na原子からCl原子に電子が飛び移ると、互いの原子は電荷を帯びた2個のイオン(ion; άɪən)が生じる。マイナスの電子を1個失ったNa原子は、正電荷を持つ陽子より負電荷の電子が一個減るため、原子は1価の正電荷を持つ(Na+)。電子を1個余分に獲得したCl原子は、陽子より電子が1個多くなり、1価の負電荷を持つ(Cl-)。Na+とCl-は、反対の電荷を持つため静電引力で互いに引き合うようになる。イオン結合したイオンは、塩化ナトリウムの結晶ができる。結晶には、ナトリウムイオンと塩化物イオンが三次元的に正確にぎっしり詰まり、反対の電荷はきっちりとつり合っている。1mm角の結晶には、天文学的な数のNa+とCl-がそれぞれ約2×1019(千京)個正確に並んでいる。イオン結合したイオンは、分子ではなく塩(えん)と呼ばれる。
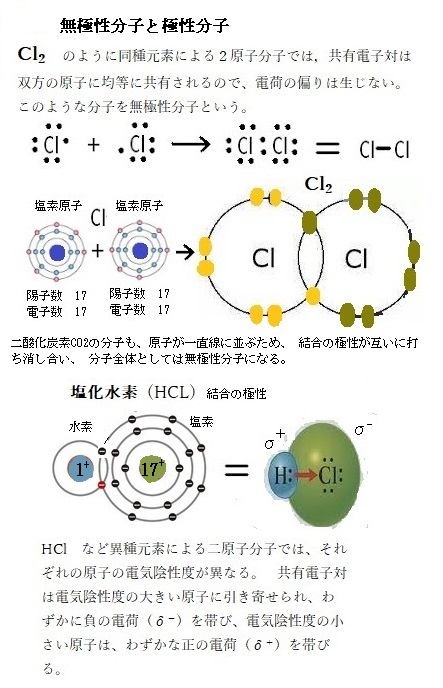
イオン結合も共有結合も最外殻を補充し合う同じ原理に基づくから、2個の原子が電子を平等に共有すると、非極性共有結合ができる。2個の原子が不平等に電子を共有すると極性共有結合ができる。一方の原子から完全に離れた電子を、もう一方の原子が獲得するとイオン結合ができる。
原理的には、イオン結合は極性が非常に高い共有結合であると言える。実際、これらの中間には、あらゆる状態の結合が生じる。極性共有結合は、イオン結合と非極性共有結合の間のどこかに位置する。イオン結合と共有結合の境界線上にある場合、非常に極性の高い共有結合と呼ぶか、イオン結合と呼ぶかは重要ではない。
水分子(H2O)は極性を持つためイオンと相互作用し易い。そのためNaClを含む大部分の塩は、水によく溶ける。NaCl が水に溶ける時、イオンのすぐ近くの水分子の水素-酸素結合は極性を持ち、酸素原子は負電荷、水素原子は正電荷を多く持つため、このような部分負電荷を持つ酸素原子がナトリウムイオン(Na+)に引き付けられ、負電荷を持つ塩化物イオン(Cl-)とは、その反発から反対に向く傾向がある。Na+とCl-のように、ばらばらになったイオンが、水分子に取り囲まれ、正電荷を持つイオンを陽イオン(カチオン)、負電荷を持つイオンを陰イオン(アニオン)と呼ぶ。Na+・Cl-・K+・Ca2+・H+(プロトン)などの小さな無機イオンは、神経細胞の電気活動を含む多くの生体反応過程で重要な役割を果たしている。これらのイオンの膜透過は、すべての細胞でのATPの生成や神経細胞での情報伝達で、最も目覚ましく活躍し、人間の挙動を左右している。
細胞はタンパク質のような巨大分子も、膜を通して選択的に輸送できるが、これには巧妙な装置が必要だ。しかし、細胞やその内部の膜に囲まれた細胞小器官への無機イオンや水溶性小分子の出入りは、それらの膜が制御する仕組みを備えている。その移動を主導する輸送体とチャンネルがある。輸送体は、その形を変えて小型の有機分子や無機イオンを膜の片側から反対側に運ぶ。チャンネルの方は、膜を貫通する小さな親水性の小孔を形成し、これらの物質を拡散により通過させる。そのチャンネルの殆どは、無機イオンだけを透過させる「イオンチャンネル」である。イオンは電荷を持つため、移動すると膜の内外に電位差を生む。この電位差が神経細胞の情報伝達に関わることになる。
 水中でのイオン結合は、分子内で原子を結びつける共有結合よりも、10~100倍弱い。その弱い結合が重要で、生体反応過程の多くは、分子間の特異的だが一時的な結合を利用している。このような非共有結合(noncovalent
bond)を介し、単独では非常に弱いが、合わさると2個の分子間に有効に働く引力を作り出す。
水中でのイオン結合は、分子内で原子を結びつける共有結合よりも、10~100倍弱い。その弱い結合が重要で、生体反応過程の多くは、分子間の特異的だが一時的な結合を利用している。このような非共有結合(noncovalent
bond)を介し、単独では非常に弱いが、合わさると2個の分子間に有効に働く引力を作り出す。塩の結晶となる、2種類のイオンNa+とCl-が結合するイオン結合は、非共有結合の1つであるが、静電引力と呼ばれる。静電引力はNa+とCl-のように参加している原子が、完全に電離している時には最も強くなるが、極性共有結合をもつ分子間でも弱い静電引力が起こる。
極性共有結合(polar covalent bonds)は、分子が電気的な力で相互作用するときの基礎になるため、生体反応では極めて重要である。
 「《polar》とは、イオン化できる、正負電荷の極性である」という意味で、多数の極性基を持つ大きな分子の表面には、部分正電荷と部分負電荷が入り混じって分布している。そのような分子が、反対の電荷分布を持った別の分子に出合うと、殆どの生物学的条件下で、水がこれらの電荷による引力を大きく減少させていても、静電引力で互いに引き合う。弱い共有結合も、大きな分子の表面に多数集まると、強く特異な結合が可能になる。
「《polar》とは、イオン化できる、正負電荷の極性である」という意味で、多数の極性基を持つ大きな分子の表面には、部分正電荷と部分負電荷が入り混じって分布している。そのような分子が、反対の電荷分布を持った別の分子に出合うと、殆どの生物学的条件下で、水がこれらの電荷による引力を大きく減少させていても、静電引力で互いに引き合う。弱い共有結合も、大きな分子の表面に多数集まると、強く特異な結合が可能になる。タンパク質のような大きな分子は、表面の電荷の分布が、ちょうど反対になっているような別のタンパク質の分子と結合できる。細胞内の水中という環境内では、大きな分子の個々の静電引力が多数集まり、2個 のタンパク質を結合させることを可能にする。
水は細胞重量の約70%を占める。細胞内の反応の殆どが水溶液中で起こる。地球上の生物は海で誕生した。生体内で起こる化学反応は水の特性を活用している。2個の水分子間で水素結合することで、典型的な哺乳類の体温でも、液体として存在でき、それが生命体を保持する数々の特性を担っている。
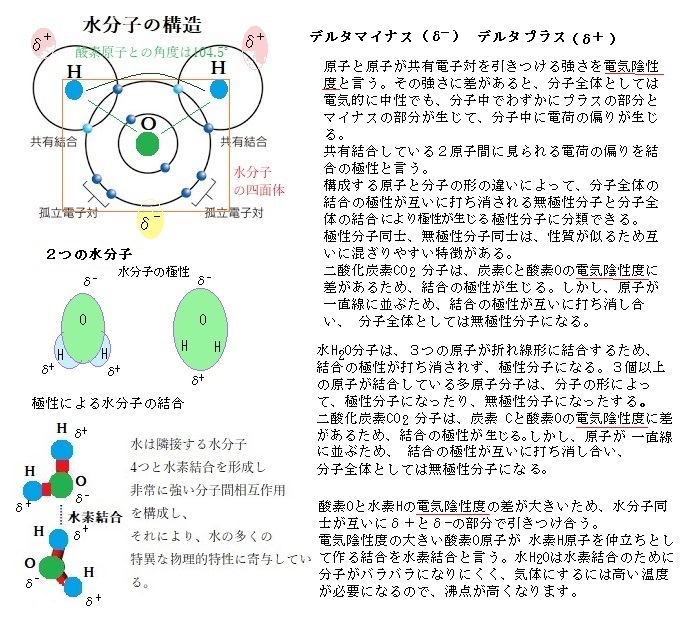
水分子(H2O)は、2個のH原子がO原子に共有結合している。O(原子番号8)はH(原子番号1)よりもはるかに強く、水素の電子を、水素の原子核より酸素の原子核に引き付けるので、2つのH-O結合は極性が非常に大きくなる。そのため水分子は電子の分布に偏りが生じ、2個のH原子は正電荷(δ+)を帯び、反対にO原子は負電荷(δ-)を帯びる。水分子は、陽子と電子を同数持つので、全体としては中性である。ただ酸素の原子核が水素原子の電子を引っ張るため、水素の原子核は僅かに正電荷を帯び、酸素原子では電子密度が増し負電荷を帯びた領域ができ、水素の2個の電子と酸素の2個の電子が、それぞれ正電荷を帯びる領域と負電荷を帯びる領域と非対称に分布するため極性を持つ。
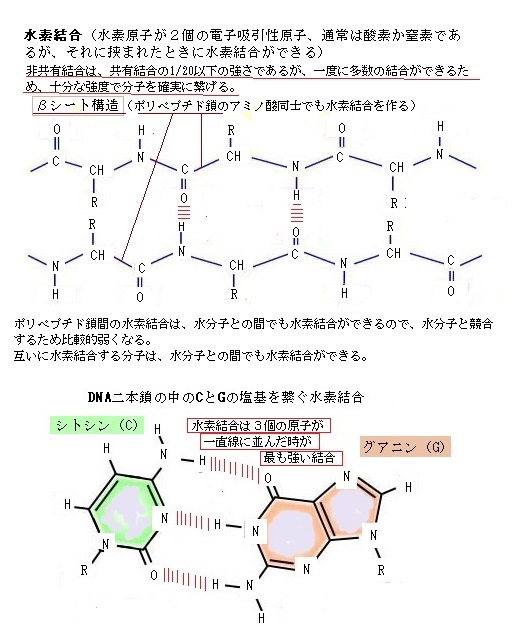
水分子の正電荷領域(H原子)の1つが別の水分子(O原子)の負電荷領域に近づくと、両者の間には電気的な引力が働き、水素結合(hydrogen bond)と呼ばれる弱い結合ができる。水素結合の強さは、共有結合よりはるかに弱く、その20分の1程度に過ぎず、熱エネルギーによる分子運動によって簡単に切れてしまう。そのため結合の寿命はごく短いが、弱い結合も集まれば見過ごせない効果を発揮する。各水分子が2個のH原子を介して、他の水分子2個と水素結合を作るので、絶えず切れたり繋がったりするが、水素結合は、酸素+水素+酸素と3個の原子が直線に並んだ時が最も強く、水素結合のネットワークができる。
水が室温で液体である時、沸点が高く表面張力が大きいのは、水分子は水素結合により一時的に水分子同士を格子状に結び付けるからだ。これが水を凝縮させ、表面張力・比熱(物質1gの温度をセ氏1℃上げるのに必要な熱量)・気化熱がいずれも高くなるなど、水素結合なしには、生命体は存在し得ない程、水の重要な特性となる。
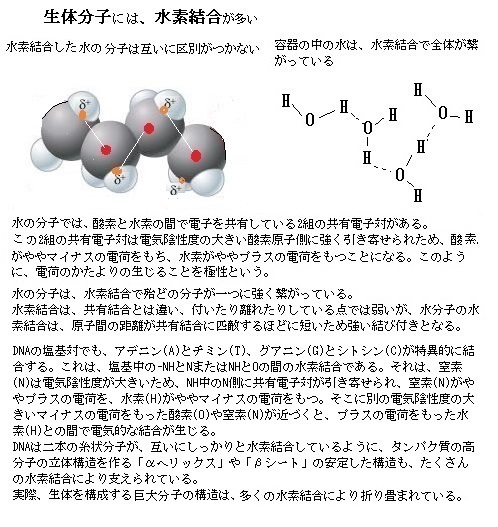 水素結合は、水だけに限られない。極性共有結合で正電荷を帯びたH原子が分子内にあり、それが別の分子の負電荷を帯びた酸素や窒素などの原子に近づいた時に水素結合ができる。大きな分子であれば、分子内で水素結合ができることもあり、これは分子を特定の形に折り畳む働きをする。
水素結合は、水だけに限られない。極性共有結合で正電荷を帯びたH原子が分子内にあり、それが別の分子の負電荷を帯びた酸素や窒素などの原子に近づいた時に水素結合ができる。大きな分子であれば、分子内で水素結合ができることもあり、これは分子を特定の形に折り畳む働きをする。アルコール(エタノールの化学式 C2H5OH)のように極性結合を持ち、水素結合を作れる分子は、水によく溶ける。正電荷または負電荷を持つ分子(イオン)も、水と結びつきやすく水に溶ける。このような分子を、親水性(hydrophilic;hàɪdrəfɪ́lɪk)分子と呼ぶ。イオンや極性分子がそれで、電荷の作用で水分子を引き付ける。水分子は、イオンや極性分子を取り囲むようにして溶液中へと運ぶ。塩化ナトリウム(NaCl)のようなイオン性物質は、正電荷を持つNa+と負電荷のイオン(Cl-)がどちらも水分子を引き付けるので水に溶ける。尿素(CH4N2O)のような極性物質は、そのH原子O原子が、周囲の水と水素結合するので水に溶ける。
砂糖(ショ糖)など多くの物質は水に溶ける。ある物質が液体に溶けた時、その混合物を溶液という。溶けた物質(ショ糖)を溶質という。溶かした液体(水)を溶媒という。水は極性結合をするので、親水性物質にとって優れた溶媒となる。その分子がばらばらになり、その各々が水分子に取り囲まれる。水に満ちた細胞内にある分子は、糖質・DNA・RNAや多くのタンパク質なども殆ど親水性である。
親水性分子とは反対に、非極性結合が優勢な物質は、電荷を持たず、水素結合を殆ど作らないため、水に溶けない分子となる。普通は水分子を引き付けないため、水分子に取り囲まれて溶液中に出ていくことはない。それで疎水性(hydrophobic;)分子と呼ぶ。
炭化水素(CmHn;C:Hの比は、n=1 m=2.67..)は、疎水性の重要な細胞構成物である。これらの分子では、H原子とC原子の間の共有結合の極性は非常に低いため、H原子が殆ど正電荷を帯びておらず、別の分子との間で水素結合ができず、炭化水素は全般的に疎水性となる。この性質により細胞内では、主に長い炭化水素鎖を持つ脂質分子から膜が作られている。脂質は水に溶けないので、細胞内の水溶液を、細胞外の水溶液から隔てる薄い膜となる。