| Top 車山高原 車山高原お知らせ 車山ブログ 歴史散歩
|
 |
DNA DNAが遺伝物質 生物進化と光合成 葉緑素とATP 植物の葉の機能 植物の色素 葉緑体と光合成
花粉の形成と受精
ブドウ糖とデンプン 植物の運動力 光合成と光阻害 チラコイド反応 植物のエネルギー生産 ストロマ反応
植物の窒素化合物 屈性と傾性(偏差成長) タンパク質 遺伝子が作るタンパク質 遺伝子の発現(1)
遺伝子の発現(2) 遺伝子発現の仕組み リボソーム コルチゾール 生物個体の発生 染色体と遺伝
減数分裂と受精 対立遺伝子と点変異 疾患とSNP 癌変異の集積 癌細胞の転移 大腸癌 細胞の生命化学
イオン結合 酸と塩基 細胞内の炭素化合物 細胞の中の単量体 糖(sugar) 糖の機能 脂肪酸
生物エネルギー 細胞内の巨大分子 化学結合エネルギー 植物の生活環 シグナル伝達 キク科植物
陸上植物の誕生 植物の進化史 植物の水収支 拡散と浸透 細胞壁と膜の特性 種子植物 馴化と適応
根による水吸収 稲・生命体 胞子体の発生 花粉の形成 雌ずい群 花粉管の先端成長 自殖と他殖
フキノトウ アポミクシス 生物間相互作用 バラ科 ナシ属 蜜蜂 ブドウ科 イネ科植物 細胞化学
ファンデルワールス引力
| 目次 |
| 1)非共有結合 |
| 2)生体内で機能する非共有結合 |
| 3)分子の極性 |
| 4)ファンデルワールス半径 |
 オランダの物理学者ヨハネス・ディーデリク・ファン・デル・ワールスJohannes Diderik van der Waalsは、「気体は分子運動で熱膨脹をするが、加熱や減圧により、気体分子の運動エネルギーは大きくなるので、分子間の引力などは無視できる。だが、気体を加圧や冷却すると気体分子の運動エネルギーは小さくなり、分子間引力が無視できなくなってくる。この結果、分子運動のエネルギーが分子間力のエネルギーよりも小さくなり液体になる。この分子間にはたらく引力を、ファンデル・ワールス力という」と説いた。分子の大きさと分子間力を考慮した気体の状態方程式を発見し、1910年にオランダ人として3人目のノーベル物理学賞を受賞した。
オランダの物理学者ヨハネス・ディーデリク・ファン・デル・ワールスJohannes Diderik van der Waalsは、「気体は分子運動で熱膨脹をするが、加熱や減圧により、気体分子の運動エネルギーは大きくなるので、分子間の引力などは無視できる。だが、気体を加圧や冷却すると気体分子の運動エネルギーは小さくなり、分子間引力が無視できなくなってくる。この結果、分子運動のエネルギーが分子間力のエネルギーよりも小さくなり液体になる。この分子間にはたらく引力を、ファンデル・ワールス力という」と説いた。分子の大きさと分子間力を考慮した気体の状態方程式を発見し、1910年にオランダ人として3人目のノーベル物理学賞を受賞した。ファンデルワールス力van der Waals force(英)は、原子・イオン・分子間や、同一分子の中の異なる原子団の間に働く引力または反発力の中で、物理的な相互作用をするものを総称した。これは、2個の原子が最接近した時に必ず起こる、電荷の揺らぎによって生じる電気的な引力である。
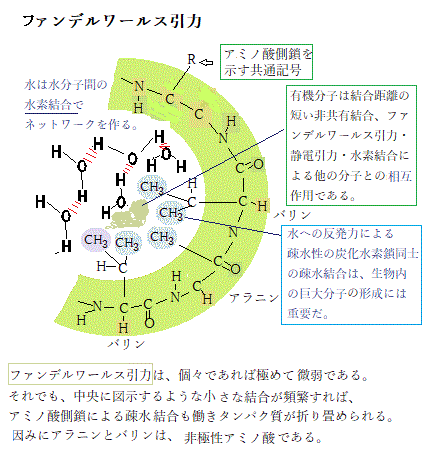
有機分子は、結合距離が短い非共有結合をする。それがファンデルワールス引力や静電引力、水素結合・疎水結合による他の分子との相互作用である。弱い非共有結合の強度は、共有結合の1/20以下であるが、ファンデルワールス引力は、水素結合よりもさらに弱い。それでも、数が増えれば多数の結合となり、しかも、巨大分子同士の表面形状にぴったり合う、選択的な結合となれば十分な強度になる。
 疎水基による水への反発力も、生物の生体における重要な巨大分子を形成する。水は水分子間の水素結合によりネットワークを作っている。疎水基は、この結合を出来るだけ破られないようにするため、水中では寄り集まる。実際には水からの反発により疎水基が集合するのであるが、その集合を「疎水結合」と呼ぶ。
疎水基による水への反発力も、生物の生体における重要な巨大分子を形成する。水は水分子間の水素結合によりネットワークを作っている。疎水基は、この結合を出来るだけ破られないようにするため、水中では寄り集まる。実際には水からの反発により疎水基が集合するのであるが、その集合を「疎水結合」と呼ぶ。生きている細胞も、非生物と同じ化学と物理の法則に従う。物質すべてが、細胞も含めて元素の最小単位の原子からできている。その元素それぞれの化学的性質は異なる。細胞を作る元素の種類は限られている。C・H・N・Oの4種類で、全質量の約96%を占める。
生物の組成は、水を除くと、残りの殆どは有機化合物とも言う有機物である。生物を物質レベルで見た時、炭素が多いことが、元素組成の大きな特徴である。炭素元素の特性は、水素や酸素、窒素などと共有結合して安定した有機化合物を作ることにある。炭素は自然界に比較的簡単な化合物から、非常に多様性に富んだ巨大な化合物を生み出している。有機化合物の組成の可能性は無限大で、そこから生物体を作るにふさわしいものを進化の過程で選別してきたようだ。地球上の生物は、すべて有機化合物からできており、しかも炭酸ガスのような簡単な炭素化合物以外、地球上のあらゆる有機化合物は、生物が作り上げたものであり、生物そのものか、その残骸としてか存在しえない。
自然界には、石油や天然ガスなど、埋蔵された大量の炭化水素(有機化合物)があるが、これらもメタン細菌と言うバクテリアが合成したものである。石炭にしても古生代や中生代の植物が埋もれて炭化したものである。炭素は4本の結合手を持っている。炭素だけで立体的に結合したものがダイヤモンドである。
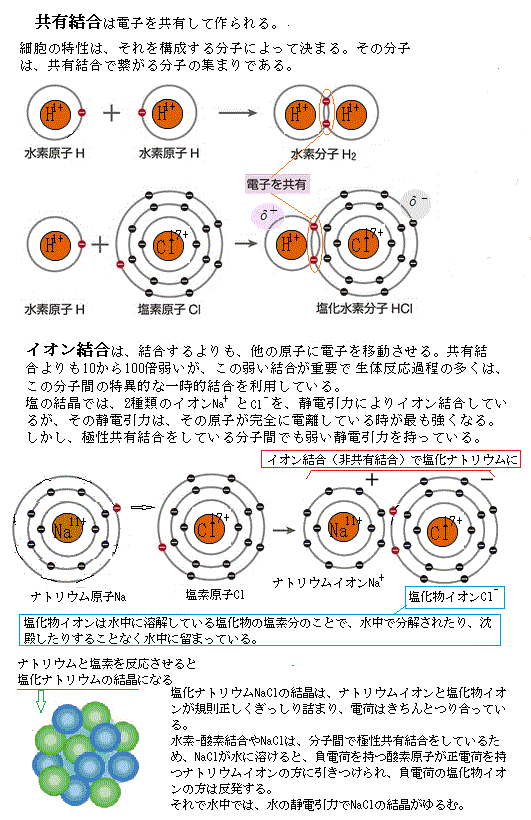 原子には、正電荷を帯びた原子核があり、その周りを負電荷を帯びた電子の雲が取り囲んでいる。原子の化学的性質は、電子の数と配置で決まり、原子の最外殻が完全に電子に満たされた時が一番安定する。最外殻電子は、最も外側のエネルギーの高い電子殻で、原子の化学的性質や活性を決定する。最外殻電子のうち、原子がイオン化したり、他の原子と結合したりするなど、反応に関与する電子のことを価電子という。ただ、大半の原子は最外殻電子と価電子は同じである。最外殻電子が満たされた状態を閉殻構造と言う。He(ヘリウム)やNe(ネオン)、Ar(アルゴン)などの常温常圧で無色・無臭・無味・無毒(酸欠を除く)で最も軽い希ガス元素は、最外殻電子があってもその全ての電子は反応に使われない。
原子には、正電荷を帯びた原子核があり、その周りを負電荷を帯びた電子の雲が取り囲んでいる。原子の化学的性質は、電子の数と配置で決まり、原子の最外殻が完全に電子に満たされた時が一番安定する。最外殻電子は、最も外側のエネルギーの高い電子殻で、原子の化学的性質や活性を決定する。最外殻電子のうち、原子がイオン化したり、他の原子と結合したりするなど、反応に関与する電子のことを価電子という。ただ、大半の原子は最外殻電子と価電子は同じである。最外殻電子が満たされた状態を閉殻構造と言う。He(ヘリウム)やNe(ネオン)、Ar(アルゴン)などの常温常圧で無色・無臭・無味・無毒(酸欠を除く)で最も軽い希ガス元素は、最外殻電子があってもその全ての電子は反応に使われない。隣り合う2個の原子が、一対の最外殻の価電子を共有する時、共有結合が形成される。2対の価電子が共有された場合、二重結合と呼ぶ。2個以上の原子が、共有結合したものを分子と呼ぶ。
巨大分子の中では、構成単位となる単位結合の原子の殆どは、周りを自由に回転できるため、重合体は変形しやすい。また巨大分子は熱エネルギーによってくねくねと変形するので、巨大分子の立体構造conformationは原理的には無限に近いはずである。ところが、分子内の様々な部分の間で弱い非共有結合が生じているので、生体内の巨大分子の形状は極めて限定されている。こうして進化の過程で形成されてきた巨大分子の独特のコンフォメーションが完成され、その化学的性質と活性が定型化され、更には他の生物分子との相互作用まで決定される。
分子を構成する原子は、陽子と中性子からなる原子核と、原子核の周りを回る電子でできている。ただし、質量数が1の普通の水素(1H)を軽水素とも呼ぶが、その原子核には陽子1つだけで、中性子は存在しない。
実は、無極性分子であっても、それを構成する原子の殆どが、自由に回転できるため「+」と「ー」の位置は、絶えず移り変わっている。これが巨大分子なると、その単量体たる分子の小さな分極は、目まぐるしく変化することになる。
分子表面はδ+、δ-、δ+、δ+、δ+、δ-・・・のように帯電していると考えられる。
電荷の揺らぎによって、電子が向いがわの分子と静電引力で引き合うと電子は動きを止める。するとその動きが止まって隣に電気的斥力repulsion(反発力)がかからないように、正電荷と負電荷が決定される。こうなると隣の電子の結合が固定されると隣の電子も決まって来る。すると、核の周りを回っていた電子の動きがとまり、+とーが引き合うようになる。こうしてある程度の必然性で、巨大分子の独特のコンフォメーションが完成される。
ファンデルワールス力の要因は、「分子の瞬間的な分極によって生じる静電気的な引力」であり、ファンデルワールス力が大きくなれば、分子同士の非共有結合が増大するからバラバラになりにくい。それで、沸点融点が大きくなる。また、結合分子が大きくなると、陽子が多くなると同時に電子が多くなる。つまり、分子量が大きくなると、分子の表面積も広がり、また揺らぐ電子の数が多くなるため、表面積にやってくれる電子が増え、それが合わさってファンデルワールス力が向上し、その分子間の結合は強固なものになる。
目次へ
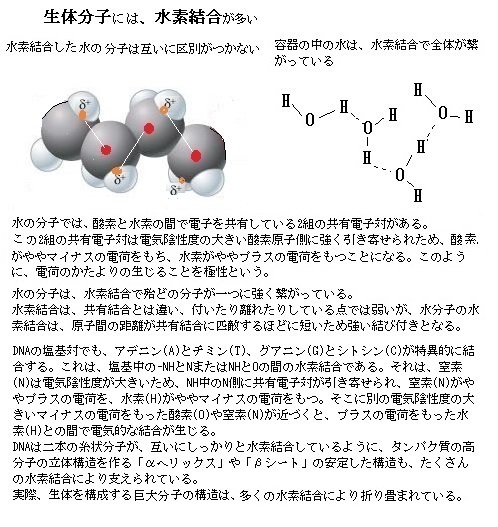
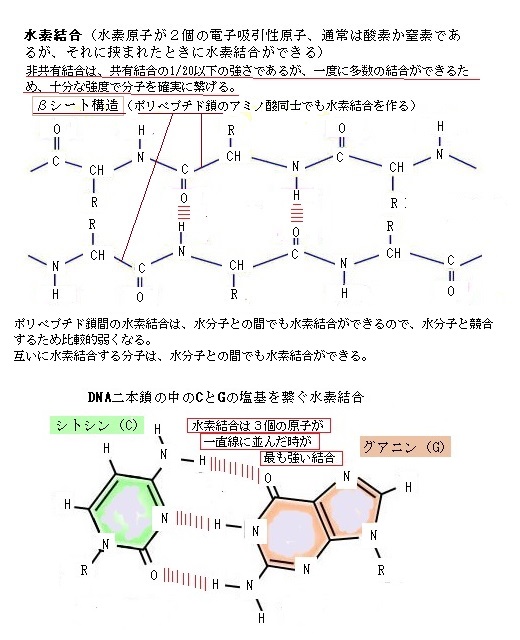 ヒトの細胞の中の巨大分子の殆どが、その相互作用を支える結合に、より強固な共有結合を採用せずに非共有結合をする理由は、巨大分子の多くが、容易に会合し解離することを前提に機能しているためである。細胞は、移動や分裂の度に、内部構造を変化させなければならない。
ヒトの細胞の中の巨大分子の殆どが、その相互作用を支える結合に、より強固な共有結合を採用せずに非共有結合をする理由は、巨大分子の多くが、容易に会合し解離することを前提に機能しているためである。細胞は、移動や分裂の度に、内部構造を変化させなければならない。また、ある細胞小器官から別の細胞小器官へ様々な成分を、頻繁に輸送しなければならない。細胞が、その重大な機能を果たすためには、共有結合であると、様々な種類の結合を解離させる局面ごとに、それぞれに特定の酵素を働かさなければならない。強固な共有結合で安定していること自体、むしろ、速やかな生命活動の障害になるようだ。
このような非共有結合により、タンパク質は酵素としての機能を発揮する。水や無機イオンにより弱められるにしても、静電引力は生体において大いに重要で、例えば正に荷電した基質に結合する酵素は、適切な箇所に負に荷電されるアミノ酸の側鎖を持っていることが多い。
また、非共有結合の個々の結合能力は弱いが、2種類の巨大分子の表面をぴったりと会合させるに足りる十分な数の結合があれば、分子の熱運動にも耐えうる安定を保つことができる。この巨大分子を構成部材として使うことで、タンパク質同士が複数結合してタンパク質複合体を作る。この複合体が複数の可動部分を備えることにより、複雑な装置となるDNAの複製やリボソームなどのタンパク質複合体などを作り上げていく。複雑な生命活動の大部分を支えている化学反応の多くは、水素結合・静電引力・ファンデルワールス引力・疎水結合の4種類の弱い非共有結合の積み重ねにより可能になっている。
この4種類の非共有結合が、ポリペプチド鎖内やRNA鎖内の領域で働いて、それらの鎖を固有の形状に折り畳んでいる。タンパク質の設計図は、遺伝子DNAに存在する。遺伝子DNAに書かれたタンパク質の情報は、いったんmRNAに転写された後に、リボソームによってアミノ酸へと翻訳され、それがポリペプチド化されタンパク質が形成される。この過程でDNAからmRNAへの転写を行うのがRNAポリメラーゼである。
DNAの遺伝情報は、塩基の4文字で書かれている。この情報がタンパク質 の合成に利用されるためには mRNAへ転写されなければならない。RNAポリメラーゼは遺伝子DNAを鋳型に、RNAの素となる4つのヌクレオシド(A:アデノシン・U:ウリジン・G:グアノシン・C:シチジン)を重合しmRNAを合成する。一つの遺伝子は一本のポリペプチド鎖をコード化している。RNAポリメラーゼは複雑な構造をした酵素タンパク質で、12 個のポリペプチド鎖から構成されている。二本鎖の DNA を包み込むように結合し、DNA に沿って 動きながらmRNAを合成していく。
目次へ
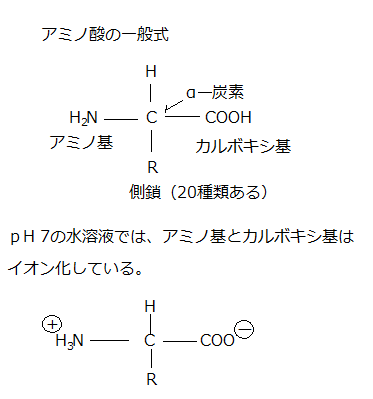 双極子dipoleとは、不均一な電荷の分布を持つ分子内に生じた電子の偏りを原因とし、一方の極が正、他方の極が負に荷電分離して発生する、ある距離を隔てて対になって存在する、正負の等価の電荷である。すなわち、分子内で、一方の極が正の電荷を持ち、他極が負の電荷に分離した、電荷分離したの配置を双極子という。
双極子dipoleとは、不均一な電荷の分布を持つ分子内に生じた電子の偏りを原因とし、一方の極が正、他方の極が負に荷電分離して発生する、ある距離を隔てて対になって存在する、正負の等価の電荷である。すなわち、分子内で、一方の極が正の電荷を持ち、他極が負の電荷に分離した、電荷分離したの配置を双極子という。
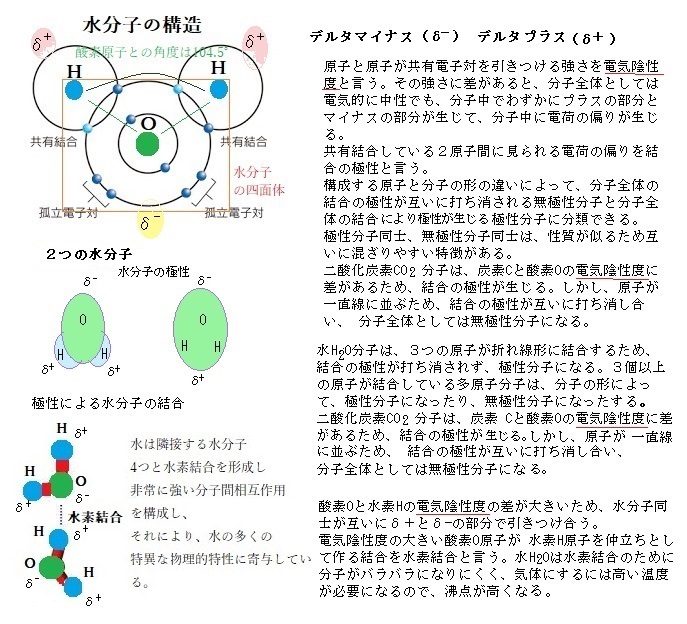
共有結合で、原子と原子が共有結合する電子対を引き付ける強さを電気陰性度という。その強さに原子間で差があると、この電子対の分布状態によりに電荷の偏りが生じる。分子全体では電気的に中性であっても、分子の中に偏りが生じマイナスの部分とプラスの部分とができる。共有結合している2原子間に起こる電荷の偏りを極性と言う。
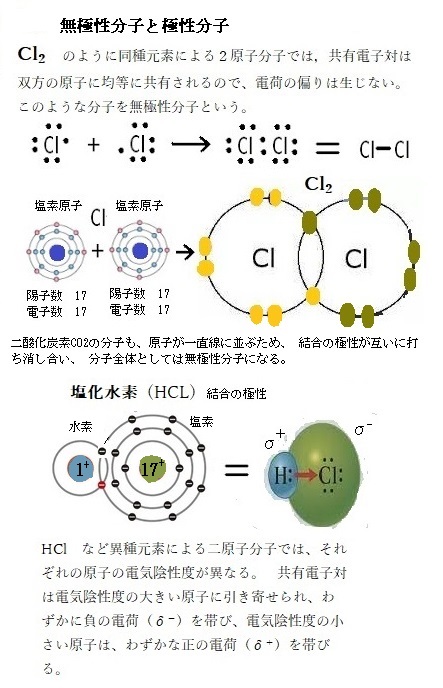
2原子分子には、同種元素による場合と異種元素による場合がある。 H2 や Cl2 のように同種元素による2原子分子では、共有電子対は双方の原子に均等に共有されるので、電荷の偏りは生じない。このような分子を無極性分子という。
HCl など異種元素による二原子分子では、それぞれの原子の電気陰性度が異なる。 このため、共有電子対は電気陰性度の大きい原子に引き寄せられ、わずかに負の電荷(δ-;デルタマイナス)を帯び、電気陰性度の小さい原子は、わずかな正の電荷(δ+;デルタプラス)を帯びる。このような極性を持つ分子を極性分子という。
化学式(構造式)の中での極性を表示する場合には、わずかな負の電荷の位置に「δ-」、わずかな正の電荷の位置に「δ+」を添えるが、δは数量の大小を示すものではない。
分子構造が、水のように折れ線形など正の荷電の重心と負の荷電の重心がずれている場合には、極性分子となる。 極性の大きさは、原子間の電気陰性度の差と重心のずれの程度に依存する。水分子はプラスとマイナスの電荷を持っているので、食塩(塩化ナチリウムNaCl)の結晶は、水中でナトリウムイオンNa+と塩化物イオンCl―に溶解し電荷を持つので水に溶ける。電荷を持つものは水に溶ける。
 極性分子は水素結合するが、無極性分子はファンデルワールス力で結合すると言うが、実際には、極性分子にも一応、「ファンデルワールス力」が働いている。
極性分子は水素結合するが、無極性分子はファンデルワールス力で結合すると言うが、実際には、極性分子にも一応、「ファンデルワールス力」が働いている。原子核は陽子と中性子からできている。陽子はプラスの性質を持った粒子で、中性子は電荷を帯びていない。その原子核の周囲を巡る電子殻を、電子と呼びマイナスの性質をもった粒子が飛び交う。電子殻の中で、原子核にごく近い軌道上にあるものは内殻電子(芯電子)と呼ばれる。一方、外側の軌道を回り、比較的弱く原子核にとらえられている電子は最外殻電子、または価電子valence electron(かでんし)と呼ばれ、物質の化学的な性質や物理的な性質を決定づけている。例えば原子が化学結合して分子やポリペプチドを形成するのは価電子の働きによっている。
ポリぺプチド主鎖から突き出しているのがアミノ酸側鎖side chainで、アミノ酸のペプチド合成には関与していないが、その側鎖が各アミノ酸の特性を定型化している。側鎖には、非極性で疎水性(水を嫌う)のもの、負あるいは正の電荷をもつもの、反応性が高いものなど様々である。
長いポペプチド鎖の炭素原子を結ぶ共有結合の多くでは、原子が自由に回転できるため自由度が高い。それで、タンパク質は膨大な様々な折り畳みが可能になる。ただ、タンパク質内にできる多数の弱い非共有結合による制限は受ける。その制限を受ける非共有結合は、アミノ酸側鎖の原子やポリペプチド主鎖の原子にも存在する。その非共有結合は、水素結合・静電引力・ファンデルワールス引力であるが、それぞれの結合力はかなり弱いので、多数の非共有結合の組み合せが必要で、それによりポリペプチド鎖内の2つの領域の結合を安定させ、その折り畳められたコンフォーメーションを確かなものになる。
第4の弱い力、疎水結合もタンパク質の形を決める重要な働きをしている。水中ではアミノ酸の非極性側鎖などの疎水性分子が集合して、周囲を取り囲む水分子の水素結合の網の目を出来るだけ壊さないようにするため、アミノ酸の極性側鎖と非極性側鎖の配置分布が、タンパク質の折り畳みを支配する重要な要因となる。
非極性アミノ酸のフェニルアラニン・ロイシン・バリン・トリプトファンなどの非極性の疎水性側鎖が、折り畳まれたタンパク質の内側に集まる傾向がある。つまり疎水性の油滴が合体して大きくなるのに似ている。これにより、内側にしまい込まれた疎水性側鎖は、水性の細胞質との接触を避けるように内部に埋め込まれ、疎水性の中心部を作る。その一方、極性アミノ酸のアルギニンやグルタミン、ヒスチジンなどの極性側鎖の多くは、折り畳まれたタンパク質の外表面に集まりやすく、そこで水などの極性分子との間で水素結合をする。
極性アミノ酸が内側に埋め込まれていても、たいてい別の極性アミノ酸がポペプチド主鎖と水素結合を作っている。タンパク質が折り畳まれたポリペプチド鎖の周辺領域では、2つの主鎖の原子間や主鎖と側鎖の原子間、2つのアミノ酸の側鎖の原子間で多数の水素結合が起きている。また同じアミノ酸の側鎖内で、複数の水素結合が作られている。
タンパク質の安定したコンホメーションは、ただ1つのはずが、細胞内で他の分子と反応して、その構造が僅かに変化することがある。このタンパク質の折り畳みの違いが、時に凝集体となり細胞ばかりでなく、組織全体が毀損される。アルツハイマー病やハンチントン病(舞踏病運動を主体とする不随意運動と精神症状、認知症を主症状とする遺伝性神経変性疾患)など多くの神経性疾患の原因となるようだ。
クロイツフェルト・ヤコブ病は、100万人に一人の割合で、大部分の患者が孤発性であるが、遺伝性も見られることはよく知られている。脳組織の海綿(スポンジ)状変性を特徴とする伝染性神経変性疾患である。プリオンと呼ばれる誤って折り畳められたタンパク質によって起こる。プリオン型は感染した脳のタンパク質を、異常なコンホメーションに変える。プリオンは凝集体を形成して、細胞から細胞へ急速に広がり組織を破壊し、感染したヒトや動物の死を招く。プリオンは、汚染した食品や血液、手術器具などを介して感染する。
動物のプリオン病としては、牛海綿状脳症 BSE、いわゆる狂牛病がよく知られている。
目次へ
万有引力のように陽子の影響でプラスの性質をもった原子核とマイナスの性質をもった電子がお互いに引き合うことで回転する。
原子の「大きさ」とは、2つの原子の電子同士の反発が十分強くなる距離、つまり、 2つの原子の半径の和 と、考えられる。ただし,電子の軌道には明確な 境界は無いため、原子の半径も一定した値があるわけでは無い。同じ原子なら「だいたい同じ」にはなるが、相手や条件によって 微妙に変わる。
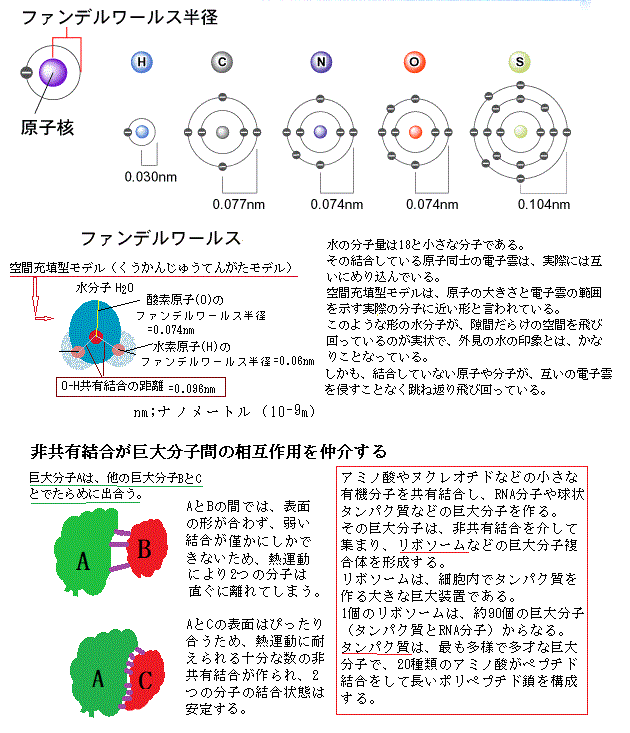 ファンデルワールス半径は、「結合を作っていない原子同士が近づける距離」このぐらいの距離までなら原子がほとんど反発せずに 近づく事ができる、と言う距離、もちろん原子の種類により半径は違う。
ファンデルワールス半径は、「結合を作っていない原子同士が近づける距離」このぐらいの距離までなら原子がほとんど反発せずに 近づく事ができる、と言う距離、もちろん原子の種類により半径は違う。原子同士が,結合していないときは、ファンデルワールス半径の和までしか近づけない。結合し一部の最外殻電子を原子間で共有結合していれば、その共有電子の軌道は、両方の原子の 軌道に広がるため反発が減り、もっと近づける。その結合半径は、当然、ファンデルワールス半径より小さくなる。
互いの原子が近づきすぎると、双方の電子同士の反発は強くなる。このため、原子は決まった半径の球として扱える。原子ごとの固有の大きさをファンデルワールス半径と呼ぶ。
つまり、その2つの原子の電子同士の反発が十分強くなる程に接する、非共有的に結合している2つの原子の半径の和を、「ファンデルワールス半径の和」と言う。
同じ原子なら「だいたい同じ」にはなるはずが、実際には、原子核を周る電子の軌道には明確な境界が無い。原子の実体は、原子核の周りを電子雲が囲んでおり、原子同士が結合していれば、互いの電子雲は互いにめり込んでいる。そのため原子の半径は、正確な値として決められない。しかも同じ原子でも、相手や条件によって、交差する電子雲の絡みは 微妙に変わる。
ファンデルワールス半径も、資料ごとに違っているのが実状である。それでも、ファンデルワールス力van der Waals forceの理論がなければ、2個以上の原子が当たり前のように接近する際に必ず生じる、電荷の揺らぎでよって起こる電気的引力を説明できない。
ファンデルワールス半径は、結合まではしていない原子同士が近づける距離であるため、「分子の接触」を考える際に一番近づける半径、即ち、このぐらいの距離までなら、双方の原子が殆ど反発せずに 近づく事ができる、と言う距離、もちろん原子の種類により半径は違う。例えば、ガス中で分子同士がぶつかる距離、結晶中で 分子がぴったり積み重なったときの距離、タンパク質を折りたたむ限界などはこれで決まる。
ファンデルワールス半径は、原子の電子同士が強く反発する距離であるため、原子の一番外側、最外殻電子の広がりで決まる。最外殻電子が遠くまで広がると、半径が大きいため、遠いところで他の原子の電子がぶつかり、直ぐ反応する。最外殻電子が原子核に近ければ、半径は小さく、直ぐそばまで電子がぶつからずに近づけるので、おおよそが予想できる。
細胞質基質(cytosol) とは、細胞質から細胞小器官を除いた、細胞の液状成分のことであるが、ゾルの中には、酵素も基質も比較的少量しか含まれていない。その中で、典型的な酵素は、毎秒約1,000個の基質分子を捕らえて反応させる。酵素には、活性部位があり、1秒の何千分の1と言う速さで、そこに1、2個の基質分子と共有結合し、酵素-基質複合体を作り、その間の反応は酵素の活性部位で起こり、酵素-生成物複合体ができあがる。その後、生成物は酵素から離れ、酵素は次の基質分子を探すために撥ねる。この反応を繰り返すことで、酵素は触媒として働く。通常、酵素は基質分子に共有結合を1つ作り、その後、結合を1つ切る。
酵素は選択性が高い。それぞれの酵素は、基質が関わるいくつかの反応の内、通常、特定の反応だけを加速させる。酵素は、他の触媒と同様、基質の反応に関わっても自身は変化しない。細胞内の様々な分子が、それぞれ定められた反応径路に入っていけるように方向付けをして、細胞に不可欠な化合物だけを作らせる。
細胞質ゾル内の分子は、熱エネルギーにより非常に速い速度で、でたらめな動きをする。各分子は、毎秒膨大な数の分子と衝突しては撥ねかえる。このため個々の分子の進行方向は刻々変わる。これをは、ランダム歩行random walkと言う。基質となる小有機分子は、平均0.2秒で10µm(10−6 m)も拡散する。微細な細胞内を移動するのであれば極めて効率的と言える。タンパク質は、小分子と比べて細胞質ゾル内での拡散は非常に遅いが、それでも基質濃度が0.05mMであるならば、毎秒5万回になる。酵素がタンパク質の基質に出合う頻度は極めて高い。
酵素と基質が何度も出合ううちに、酵素-基質複合体ができる。両者の間に弱い非共有結合がいくつもでき、その会合状態は安定する。水素結合・ファンデルワールス引力・静電引力が、ランダムな熱運動で解離されるまで結合する。それが2つの分子の表面がよく合わないと非共有結合は殆ど形成されないため、その僅かな結合エネルギーでは熱運動エネルギーに耐えられず、2つの分子は接触するやいなや解離する。これにより酵素と基質間に不適切な結合が起こらないようにされている。
目次へ