| Top 車山高原 車山高原お知らせ 車山ブログ 歴史散歩
|
 |
DNA DNAが遺伝物質 生物進化と光合成 葉緑素とATP 植物の葉の機能 植物の色素 葉緑体と光合成
花粉の形成と受精
ブドウ糖とデンプン 植物の運動力 光合成と光阻害 チラコイド反応 植物のエネルギー生産 ストロマ反応
植物の窒素化合物 屈性と傾性(偏差成長) タンパク質 遺伝子が作るタンパク質 遺伝子の発現(1)
遺伝子の発現(2) 遺伝子発現の仕組み リボソーム コルチゾール 生物個体の発生 染色体と遺伝
減数分裂と受精 対立遺伝子と点変異 疾患とSNP 癌変異の集積 癌細胞の転移 大腸癌 細胞の生命化学
イオン結合 酸と塩基 細胞内の炭素化合物 細胞の中の単量体 糖(sugar) 糖の機能 脂肪酸
生物エネルギー 細胞内の巨大分子 化学結合エネルギー 植物の生活環 シグナル伝達 キク科植物
陸上植物の誕生 植物の進化史 植物の水収支 拡散と浸透 細胞壁と膜の特性 種子植物 馴化と適応
根による水吸収 稲・生命体 胞子体の発生 花粉の形成 雌ずい群 花粉管の先端成長 自殖と他殖
フキノトウ アポミクシス 生物間相互作用 バラ科 ナシ属 蜜蜂 ブドウ科 イネ科植物 細胞化学
ファンデルワールス引力 タンパク質の機能
 物質の種類は無数であるが、古代ギリシアでは、タレスが水を、アナクシメネスが空気を、ヘラクレイトスが火を元素と考えた。
物質の種類は無数であるが、古代ギリシアでは、タレスが水を、アナクシメネスが空気を、ヘラクレイトスが火を元素と考えた。その後、アリストテレスが土、水、空気、火が元素であるとし、これら元素の実体は根源的な粒子であると考えた。これを「アリストテレスの四元素説」という。
つまり、物質は「限られた少数の成分の組み合わせで成り立っているのではないか?」といった考えが紀元前からあった。このような、すべての物質の根源となる成分を元素と呼んだ。
今日では、様々な実験的な手法を駆使した研究により、物質の根源となる成分は原子であることが証明されている。つまり、元素の実体は原子であった。
原子の性質は、その原子が含む陽子の数によって決定される。炭素原子は6個、窒素原子は7個、酸素原子は8個の陽子を持つ。各原子のそれぞれ固有の性質は、各々の陽子の数によって決まる。
しかし、陽子の数が同じでも、炭素のように中性子の数が異なれば違う原子とみなされる。
ただ、その原子核の中にある陽子の個数を表した原子番号で、原子を区別する方がなにかと便利であ。中性子の数が違っても、陽子の数が同じなら原子番号が同じであるため、同じ元素とみなされる。酸素原子は8個の陽子を持つ。原子番号は8である。
つまり、原子の性質は、その原子が含む陽子の数によって決定されるため、元素とは中性子の数に拘らず、同じ数の陽子を持つ原子のグループのことを言う。
同一の元素に属する原子は、すべて同一の数の陽子を持つが、中性子の数が異なることがある。同じ元素で原子番号が同一でありながら、中性子の数が違い、質量数が異なる原子を同位体という。
例えば、水素の陽子数は1であるが、中性子が0個の水素、中性子が1個の水素、中性子が2個の水素がある。 それぞれの同位体は、陽子と中性子の総数を、質量数として元素記号の左上に書き表すのが慣例となっている。
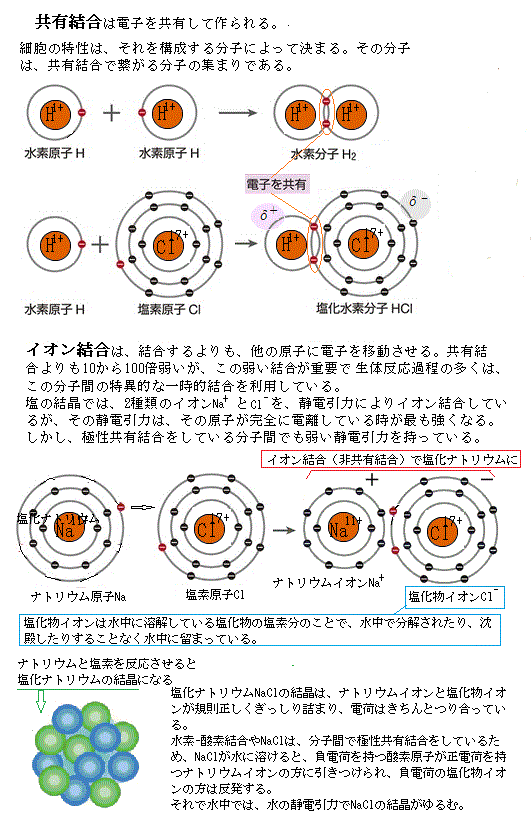
原子は相互に繋がり合うことができる。これを化学結合という。様々な原子が様々に化学結合することによって、宇宙に無数の物質と地球上には無数の生物が存在できる。
原子は、中心にある正の電荷を帯びた陽子と、電気的に中性な中性子から成り立っている原子核と、その周囲を取り囲む負の電荷を帯びた電子によって構成されている。電子はマイナス、陽子はプラスに帯電しており、極性が逆であるだけで電荷の大きさは同じである。原子核内の陽子の数と、その原子核を取り巻く電子の数は同一なので、原子全体では中性である。
電子が動き回る領域を電子殻、または軌道という。最外殻にある電子のうちのいくつかは、外部からの刺激によって軌道から離れる。電子が軌道から離れると、原子核のプラス電荷に比してマイナスの電荷が不足するので、原子は全体でプラスに帯電する。この状態がプラスイオンである。反対に外部から来た電子を自分の軌道状にとらえると、マイナスの電荷が増すので、原子全体ではマイナスに帯電する。この状態がマイナスイオンである。プラスイオンとマイナスイオンを総じてイオンと呼ぶ。
イオン化というと、分子や原子がプラスイオンかマイナスイオン、どちらかのイオンになることを指す。
| 目次 |
| 1)物質を構成する元素 |
| 2)酸性と塩基性 |
| 3)茅野市平成30年度水質検査 |
| 4)ポリペプチド鎖polypeptide |
| 5)タンパク質の構造 |
| 6)タンパク質は四次元構造を作る |
| 7)パーマネントウエーブの原理 |
 生物の体を構成する元素に、特別変わったものはない。数種の元素からなる小数の分子群が、驚くほどの多様な生物の形態と生態を生み出している。生物の体を構成する分子の特徴は、地球上の表面にあるごくありふれた酸素・炭素・水素・窒素で95%以上を占め、水が70%、有機化合物が25%位を占めている。
生物の体を構成する元素に、特別変わったものはない。数種の元素からなる小数の分子群が、驚くほどの多様な生物の形態と生態を生み出している。生物の体を構成する分子の特徴は、地球上の表面にあるごくありふれた酸素・炭素・水素・窒素で95%以上を占め、水が70%、有機化合物が25%位を占めている。炭素原子が中心になって、他の原子が結合しているようなものを、特に有機化合物と言い、炭素原子を含まないものを無機化合物と言う。しかし、炭素を含む二酸化炭素・一酸化炭素・炭酸ナトリウム・二硫化炭素(化学式はCS2、構造式はC=S=C)といったようなものは、通常、生物が生成しないためか、無機化合物に分類されている。
「生物は有機化合物でできている。しかも生物は有機化合物を作ることができる」。ただ、自然界では、有機物を全く作れないと断定すべきでない。重要なことは、地球上の物質でもある生物であれば、定義に拘ることなく、むしろその無機物との共通性を探ることの方が、もっと面白い。
自然界で自然に起こる反応は、エネルギーの高い状態から、エネルギーを放出して、エネルギーの低い状態へ変化する発熱反応である。
熱力学第一法則は、物質が固体から液体、さらに気体へと変化することはあっても宇宙の中の物質およびエネルギーの総量は一定を維持している、と定義する。
熱力学の第二法則では、「熱は温度の高い方から低い方に伝わるが、温度の低い方から高い方に自然に伝わることはない」。どんなものでも、放っておけば、遅から早かれエネルギーを放出して、低エネルギー物質、あるいは状態へ変化して落ち着く。周囲からエネルギーを集める吸熱反応は、自然界では、通常起こりえない。自然界には、エネルギーを放出する反応しか起こりえない。
ただ、二硫化炭素は、火山地帯の天然硫黄として豊富に存在する。CO2同様にほぼ無蔵と言える資源である。 工業的には、水分や揮発分を除いた木炭やコークスなど赤熱した炭素源に、イオウを850~950℃で反応させる。
C + 2S ⇔ CS2 (carbon disulfide)
或いは、天然ガス中などのメタンを炭素源に、シリカ(二酸化ケイ素SiO2)を触媒にして600°Cでイオウと反応させる。
CH4 + 4S ⇔ CS2+2H2S
炭化水素hydrocarbonを主成分にする石油などのように高いエネルギーを持つ有機化合物は、酸素と結合して燃える。燃えることで低いエネルギーの分子の炭酸ガスになり安定するのは自然に起こる現象である。この過程で、差額のエネルギーは遊離して、熱や光を放出する。自然界の炭素は、一番エネルギーが低い炭酸ガスとなって安定する。それ以上の変化には、新たなエネルギーが加わる必要がある。自然界の鉄が酸化鉄iron oxide(FeO、Fe2O3)として存在するのも同様の反応による。
酸化鉄を作るときに鉄を熱する。熱した鉄に空気中の酸素が結合して黒サビ、つまり酸化鉄ができる。黒サビは、赤サビを防ぐ役目もする。水分と空気中の酸素によってできるのが赤さび、また、酢などをつけておくと、直ぐに酸化されて赤さびが生じる。
鉄の原料である自然界の鉄鉱石は、主として鉄と酸素からなる安定した酸化物で、この鉄鉱石から酸素を分離して作られた鉄は、元の安定した酸化物に戻ろうとして、温度や湿度などの環境の影響を受けやすい。この酸化物が錆と呼ばれる。しかし、鉄を自然の中に放置しておけば必ず錆びるというものではなく、錆びるには空気中の酸素と水分の両方が必要である。
(1) Fe → Fe2+ + 2e-
鉄は、水に接するとイオン化Fe2+し、水の中に溶け込もうとする。 この時、金属中に電子e-が取り残され、この反応は進行する。
(2) 1/2 O2 + H2O + 2e- → 2OH-
白然界においては、この電子(e-)は、水中にあらかじめ溶けている「溶存酸素」と呼ばれる酸素が捉えて、水酸化物イオン2OH-に変化する。
(3) Fe2+ + 2OH- → Fe(OH)2
この電子を電気的に取り除くのは電気分解であり、水中の水素イオンH+によって取り除くのは、酸性水溶液中における水素ガスの発生の放出(2H + 2e- → H2↑)をともなう鉄の溶解である。鉄イオンと水酸化物イオンが反応して水酸化第一鉄Fe(OH)2の白濁物を生成する。
(4) 2Fe(OH)2 + H2O + 1/2 O2 → 2Fe(OH)3
水酸化第一鉄Fe(OH)2は、さらに酸化されて、水酸化第二鉄の赤褐色沈殿Fe(OH)3の赤褐色に沈澱する。
鉄さびの成分は、オキシ水酸化鉄(FeOOH)と呼ばれるα-やβ-、γ-FeOOHとマグネタイトmagnetite(磁鉄鉱;Fe304;四酸化三鉄)及び(非晶質状態にある)無定形酸化物からなる。それらの組成は、さびができる環境によって異なる。鉄さび中のオキシ水酸化鉄は鉄イオン水溶液から、いろいろな過程を経て生成される。一般に、さびができる環境には、水が存在する。鉄さびと水分子の相互作用は、金属鉄がFe2+となって溶け、酸化、加水分解などによって水酸化物、オキシ水酸化物及び酸化物粒子が生成する過程と考えられる。
石炭や石油、木材、紙はいずれも有機化合物であり、燃やすと酸素と結合して炭酸ガスになる。燃やすという現象には、エネルギーの放出が伴う。つまり、炭化水素を主成分にする石油と酸素と言う分子は、それぞれ分子として固有のエネルギーを持っている。それが燃えて炭酸ガスと水になった時、その大きなエネルギーが熱と光として放出される。つまり炭酸ガスと水が持つエネルギーは、石油と酸素それぞれの分子が持つエネルギーより低いため、その差額を熱と光のエネルギーに変えて放出される。
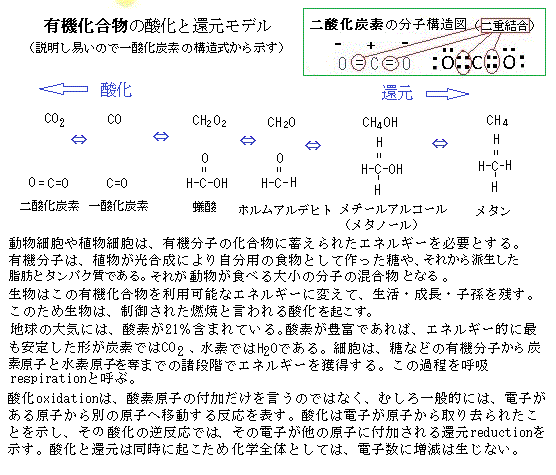
炭酸ガスや水は、有機化合物の中では、これ以上は酸化されない、一番安定した分子で、分子として持つ固有のエネルギーが一番低いレベルにある。逆に炭酸ガスが還元されていくと、順に一酸化炭素・蟻酸(ぎさん)・ホルムアルデヒト・メチルアルコール・メタンと並ぶ。還元とは、酸素を外して水素を加えることでもあるから、分子としては、右に行くほど還元された状態となり、その固有のエネルギーがより高く保有されている事になる。
有機化合物は、炭酸ガスに比べて還元された物質であるため、分子としては高いエネルギーを持っている。つまり自然界にある炭酸ガスから有機化合物を作ることは、低エネルギー分子から高エネルギー分子を合成することであるから、決して容易なことではない。炭酸ガスから有機物を作る反応は、エネルギーを吸収して起きる吸エネルギー反応(吸熱反応)である。しかし、炭酸ガスと水分子にエネルギーを注入して、高エネルギーの分子にすることは、通常、あり得ない。そのための特別な分子装置が必要になるから、自然界では、炭酸ガスから有機物ができることは、ごくまれである。
 生物が活動するためには、エネルギーが必要だ。それは細胞個々の働きでも同様で必須である。植物と違い人間も含めて動物たちは、無機物をエネルギー源に転換できない。他の生物が作り出すアミノ酸や脂質といった有機物を、直接または間接的に食べることで生きている。砂糖は、植物のサトウキビやテンサイ(砂糖大根)から得られるエネルギー源であるが、塩は鉱物でエネルギー源に成りえない。このように他の生物に依存する生物を従属栄養生物と呼ぶ。
生物が活動するためには、エネルギーが必要だ。それは細胞個々の働きでも同様で必須である。植物と違い人間も含めて動物たちは、無機物をエネルギー源に転換できない。他の生物が作り出すアミノ酸や脂質といった有機物を、直接または間接的に食べることで生きている。砂糖は、植物のサトウキビやテンサイ(砂糖大根)から得られるエネルギー源であるが、塩は鉱物でエネルギー源に成りえない。このように他の生物に依存する生物を従属栄養生物と呼ぶ。人間の体内には、成人で体重の約5%の塩分があり、塩分の多くは骨格や筋肉中に含まれ、体重の約60~70%を占めている体液にも塩分が含まれている。
一方、他の生物が生成する有機物に頼らず生存を全うする独立栄養生物もいる。陸上植物および緑藻などの緑色植物は、光合成によって太陽エネルギーを利用して自分を支えるエネルギーや有機物を生産している。
地球上で最初に光合成を行なったと考えられる光合成細菌photosynthetic bacteriaとは、光エネルギーによる光合成を行う細菌の総称である。細菌だから単細胞で原始的な生物である。太陽光を生存のためのエネルギーとして、地球上で最初に光合成を行なった生物とみられている。
それまでは、どのようにしてエネルギーを得ていたのか。雷などの自然現象によって生じた有機物のエネルギーや、地中から噴き出す硫化水素H2Sなどの無機物から得られたエネルギーなど、いずれにしても量的にはそれほど多くはない。
土の中の小さな生き物や微生物は、生物の排泄物や死体などの有機物を分解して無機物に変える働きをしている。自然界の分解者と呼ばれている。それを植物が栄養素として吸い上げるというのが循環の第一歩である。
植物は炭酸ガスと水から有機物と酸素を作り続ける。つまり、植物は、その生体内で有機物を作るため、本来不可能なはずの炭酸ガスを還元する反応を平気で行っている。それが植物の細胞小器官として存在する葉緑体による生合成反応、つまり光合成反応そのものである。葉緑体と呼ばれる複雑にして精密な装置で、太陽光の高エネルギーを分子に注入し、それぞれの分子は高エネルギーを吸収して、発熱反応をしながら有機化合物の分子を作っている。反応全体としては、吸熱反応であるが、最初に太陽光から十分に高いエネルギーが得られた高エネルギー分子から開始されたため、その後の発熱反応はスムーズに進められる。実際には、太陽光エネルギーの受容から、葉緑体へのエネルギーの注入、それから始まる有機化合物の合成まで間、複雑にして精緻な長い反応径路をたどる。植物は、そういった特殊な分子レベルの装置を豊富に備えている。
光合成以外の吸熱反応は、植物はもとより、あらゆる生物の体内で日常的に行われ、それが生物の大きな特徴になっている。例えば、生物の体内では、自己の生命を維持するために必要な、様々な物質を変化させる代謝と呼ばれる反応径路がある。その径路には、吸熱反応が豊富に含まれている。生物を構成する有機化合物の殆どは高分子で、その高分子を合成する過程が吸熱反応である。動物の体内では、神経や筋肉が活発に活動している。これも吸熱反応で、特定の分子にエネルギーを効率的に供給し続けることで吸熱反応が絶え間なく進行する。そのエネルギーの供給源は、糖や脂肪などのエネルギー源の摂取であり、それを熱エネルギーとして吸熱反応を行う。生物は、これほどの装置を、細胞単位で当たり前のように備えている。生物40億年の進化の歴史は、ユーラシア大陸レベルの生滅が繰り返される過酷なまでの環境変化の試練に、適応と馴化、突然変異で辛うじて生き残りえた生物の現在の姿が語りつくしている。
Ppmとは、parts per miliion の略で百万分の1(10-6)を表す指標。主に微量物質の濃度を表すのに用いられる。ppm は割合を 106 倍(百万倍)した値であることを表し、% は割合を 102 倍(百倍)した値であることを表している。 したがって、ppm 単位から % 単位に変換するには、値を 10-4 倍(0.0001 倍)すればよく、逆に、% 単位から ppm 単位に変換するには、値を 104 倍(10000 倍)すればよいことが分かる2 。
地球の中心部は、固体の内部コア(内核)と液体の外部コア(外核)に分かれている。地球の形成過程において、初期のコアはすべて液体であったが、冷却によってある時点からコアの結晶化が始まり、固体の内部コアが出現したと考えられている。
重い元素は、地球の中心まで沈んでいる。地表には軽い元素が多い。地殻を構成する元素で一番多いのが酸素47%とケイ素(Si)28%である。次いで、アルミニウム(Al)8%、鉄(Fe)、カルシウム(Ca)4%、ナトリウム(Na)3%、カリウム(K)3%、その他2%となる。地表の2/3を占める水は、酸素と水素でできている。現在の大気は、窒素が78%、酸素が21%、この2つが大部分を占めている。
生物の組成は、酸素・炭素・水素・窒素を合わせて95%を超えている。地球のありふれた元素からできている。釘2~3本分の鉄も含まれているが、重い元素はごく僅かである。ただ生物と地球表面の元素組成との明確な違いは、生物はケイ素も使うが、圧倒的に炭素が多い。ケイ素(原子番号 14)も最外殻の電子の数が同じであっても、その能力は比べようもなく劣っている。 黒曜石obsidian類の成分70~75%の二酸化ケイ素SiO2、特に水晶には99%以上含まれている。珪素が酸化すると二酸化珪素SiO2、即ちガラスの主成分、純粋に近い二酸化珪素が、いわゆる水晶である。地球上の岩石の主成分は二酸化ケイ素、月の岩石に最も多く含まれている元素は、ケイ素と酸素と言う。
火山ガラスと呼ばれる黒曜石は、火山岩の一種で、加工された宝石ではないため、その岩石を黒曜岩(こくようがん)と呼ぶこともある。黒曜石は鉱物mineralのようで、実は鉱物ではない。
地質学の鉱物とは、
1.結晶質の固体であること。
2.自然に生成されること。
3.無機物であること。
4.ある特定の化学組成を持つこと。
5.特有の物理的性質を持つこと。
結晶とは、原子あるいはイオンが、三次元の空間に、ある特定の順序できちんと並んでいる物質である。
例えば、花崗岩は、ある部分は石英の結晶粒子が、他の部分にはカリ長石KAlSi3O8や白雲母が存在する。つまり、花崗岩は、鉱物の集合体であるため鉱物ではなく、岩石rockである。
黒曜岩は、構成要素が複雑なため結晶化が不十分で、殆どがガラス質であるが、単一の鉱物を形成していない。黒曜石は通常、水分含有量が1%以下であるが、水にさらされると徐々に水分を含み、真珠岩perlite(ガラス質の流紋岩質火山岩、化学組成は松脂岩や黒曜石とほぼ等しい)と呼ばれる岩石に変質する。そのため、「ミネラロイドmineraloid」(非晶質の鉱物)という分類に入れられる。
鉱物は、溶岩が冷める時や、一度溶岩が固まって出来た岩石が埋没する時に圧力・温度が上昇することによって、天然自然に生成される。また、温泉水のように、熱い水が岩石の割れ目などを通過するときに、熱水中に溶解した物質と岩石中の鉱物が反応することにより、新しい鉱物が析出したりもする。
黒曜石は、たとえば海底火山などから噴出したケイ素を含む溶岩が急速に冷却され、結晶形成が最小限にとどまったときに生成されると考えられている。黒曜岩は、粘着性と化学重合の度合いが大きい流紋岩質マグマの中に見出される。それで、このマグマは「黒曜石流obsidian flow」と呼ばれることもある。粘着性と重合性が高いと、原子の拡散が妨げられ、結果として結晶の生成が阻害される。黒曜石を割ると、極めて鋭利な貝殻状破面conchoidal fractureが出来る。この「結晶の未成長」が原因と考えられている。
その組成は、70~75%の二酸化ケイ素SiO2(英: silica、無水ケイ酸)、及び酸化マグネシウム MgOと四酸化三鉄Fe3O4(自然界では鉱物の磁鉄鉱、いわゆる「黒錆)。非晶質、色は黒・灰・深緑・赤・黄、光沢は石英光沢、モース硬度は5~5.5。
イネ科の葉の切れ味が鋭いのは、葉の縁のギザギザのせい、また全体に、石英(ガラス)にも含まれるケイ素により細胞壁が堅くなっているためでもある。ケイ素は、「英;silicon」・「硅素」とも表記され、地殻中 に大量に存在するケイ酸塩鉱物として大きなグループを形成している。特に、二酸化ケイ素SiO2(シリカ)はケイ素の酸化物で、地殻を形成する物質の一つとして重要である。これには Si-O-Si 結合の多様性を反映し、様々な鉱物に含まれている。 ケイ素は、植物の代謝にはかかわっていないようだが、少量であっても、有用で必須の元素である。イネ科植物・シダ植物などにおいて二酸化ケイ素のかたちでの表皮の細胞壁と維管束の組織に大量に蓄積されている。それにより水分損失を減らし、真菌感染を妨ぐ。現在の医学・獣医学では、病原体としての菌類を細菌と区別して真菌と呼ぶ。
また二酸化ケイ素は、単細胞性の藻類のグループである珪藻の細胞壁の重要な部位を形成している。 イネ科植物は、土の中の水に溶けた珪酸を根から吸収し、特定の細胞にためていく。細胞がすっかりガラス質に変わったものを、プラントオパールplant opal(植物珪酸体)と呼ぶ。二酸化ケイ素により、イネ科の細胞の一部は、分解されずに化石(プラントオパール)として残る。 イネ科の葉の多くは、トウモロコシやサトウキビのように、二酸化ケイ素の働きで葉が直立するので、密に生えることが可能になる。それにより、面積当たりの収穫量が高まる。プラントオパールを作る細胞は、葉の表面に見える白い筋にある。葉を縦に切ってみると、透明なブロック状のものが一列に並んでいる。その一つを別の角度から見てみると、扇形をしている。これもイネの細胞の中に作られたプラントオパールである。
プラントオパールには、植物それぞれを特定できる独特の形状がある。扇形はイネ科特有の形、ヨシやススキ、トウモロコシなどにも、それぞれ植物種固有の形がある。古代の地層に残されたプラントオパールを調べると、その時代の植物の植生が分かる。プラントオパールは、珪酸質なので、花粉化石などが残りにくい土壌、遺構内の焼土や灰、土器胎土にも残存する。イネ科植物の栽培の歴史過程たどる手掛かりにもなっている。
ただ、プラントオパールの粒子は小さく、雨水と共に地下に浸透する。つまり、別の時代のものが混入している可能性が高い。年代推定の精度を上げるため、プラントオパール中の放射性炭素14Cを解析する年代測定法も試みられている。
ケイ素の原子番号14で、炭素同様、最外殻の電子の数が4個と同じであっても、炭素原子(原子番号6)は小さく4つの共有結合が作れる。特に大事なのは、炭素原子同士が非常に安定的な「C-C共有結合」を作る事である。このため鎖状や環状、枝分かれ構造などの分子、更には巨大で複雑な分子を、限りなく大きくできる。
有機化合物の種類は、極めて豊富で、それは、炭素原子の性質として、炭素原子同士、また酸素・水素・窒素・イオウ・リン・ケイ素その他のいろいろな原子と結合する力が強いことによる。水を除けば、細胞内のほぼすべての分子は炭素を基本にしている。炭素は元素の中でも、大きな分子を作る能力が突出している。ケイ素も最外殻の電子の数は同じであるが、その能力は炭素より格段に落ちる。炭素原子は小さく、最外殻に電子4個の空きがある。4つの共有結合ができる能力があり、特に炭素同士のC-C共有結合が非常に安定していることが重要である。
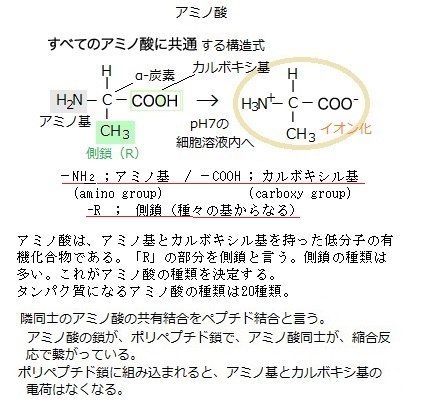
細胞が作る炭素化合物は、分子の大小を問わず有機分子organic molecule、それ以外のすべての分子は、水も含めて無機分子inorganic moleculeと呼ぶ。 タンパク質は、単位となるアミノ酸が連なる、分子量が数万~数十万にもなる高分子でできている。アミノ酸は、アミノ基(-NH2)とカルボキシル基(-COOH)を持った低分子の有機化合物である。アミノ酸には、種々の基からなる側鎖が付いて、アミノ酸の種類を決定する。タンパク質の材料になるアミノ酸は20種類である。
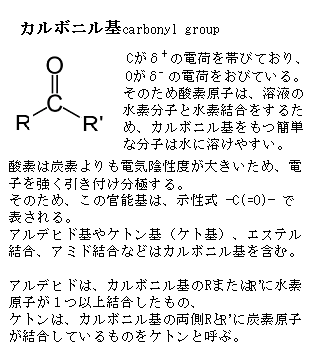
メチル基(-CH3)・ヒドロキシ基(-OH)・カルボキシル基(-COOH)・カルボニル基(>C=O)・ホスホリル基またはリン酸基(-PO32-)・アミノ基(-NH2)など、決まった原子の組み合わせがあり、有機分子に頻繁に現れる。このような基chemical groupには、それぞれ特有な物理的、化学的性質があり、プロトンproton(H+)の授受の傾向や、その基を含む分子と相互作用する分子の種類などに影響し、生体内の化学反応が詳細に理解されるようになる。例えば、基はATP や DNA あるいは RNA の官能基(functionalgroup;有機化合物を特性づける原子団)となって結合しているため、生体内での化学的反応が理解しやすくなる。
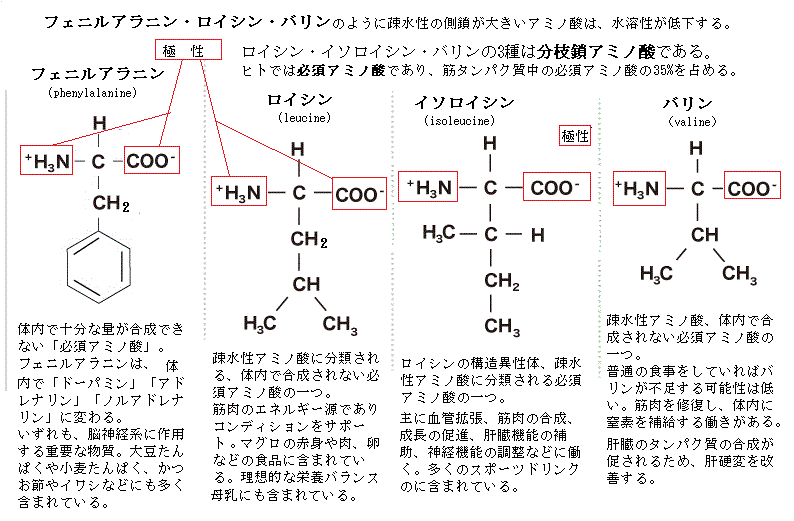 アミノ酸は、1つの分子の中に塩基性を示すアミノ基(塩基性基)と、酸性を示すカルボキシル基(酸性基)の両方を持った両性電解質である。水溶液中では、アミノ基(-NH2)は、水素イオン(プロトン)を結合して-NH3+となり、カルボキシ基(-COOH)はプロトンを解離して-COO-となる。アミノ酸は分子の中にイオンになる基を2つ持っているから、親水性のはずなのに、ロイシンやフェニルアラニンのように疎水性の側鎖部分が大きなアミノ酸は、水溶性が低くなる。そこからアミノ酸の多様性が展開する。
アミノ酸は、1つの分子の中に塩基性を示すアミノ基(塩基性基)と、酸性を示すカルボキシル基(酸性基)の両方を持った両性電解質である。水溶液中では、アミノ基(-NH2)は、水素イオン(プロトン)を結合して-NH3+となり、カルボキシ基(-COOH)はプロトンを解離して-COO-となる。アミノ酸は分子の中にイオンになる基を2つ持っているから、親水性のはずなのに、ロイシンやフェニルアラニンのように疎水性の側鎖部分が大きなアミノ酸は、水溶性が低くなる。そこからアミノ酸の多様性が展開する。 元素の性質は、その原子が含む陽子の数によって決定される。炭素原子は6個、窒素原子は7個、酸素原子は8個の陽子を持つ。各原子のそれぞれ固有の性質は、各々の陽子の数によって違ってくる。ところが、陽子の数が同じで原子番号が同一でも、中性子の数が異なれば違う原子とみなされる。
元素の性質は、その原子が含む陽子の数によって決定される。炭素原子は6個、窒素原子は7個、酸素原子は8個の陽子を持つ。各原子のそれぞれ固有の性質は、各々の陽子の数によって違ってくる。ところが、陽子の数が同じで原子番号が同一でも、中性子の数が異なれば違う原子とみなされる。原子核を構成する陽子の個数を原子番号(記号Z)と言う。一方、陽子の個数と中性子の個数の和を質量数(記号A)と言う。ZとAはそれぞれ元素記号の左下、左上に添え字で表す。原子の中には原子番号が同じで、質量数が異なるものがある。これらの電子雲は同じだが、質量数(重さ)が異なり、このような原子を同位体と呼ぶ。炭素には12C、13C、14Cなどが知られているが、大量に存在するのは12C、原子番号が同じ原子の集合を元素と言う。炭素という元素には、3種 以上の原子(同位体)が存在する。 細胞内のほぼすべての分子は、水を除けば、炭素を基本にしている。炭素は原子の中でも、大きな分子を作る能力が突出している。
ヒトの体内のすべてのタンパク質は、たった20種類のアミノ酸からできている。この20種類のアミノ酸は、体の中で作ることのできない必須アミノ酸と、体の中で作られる非必須アミノ酸とに大きく分けることができる。必須アミノ酸は、体内では合成されず、必ず食物から補給しなければならない、9種類である。非必須アミノ酸は、体内で合成できるが、様々な働きがあるため、摂取したいアミノ酸でもある。11種類ある。
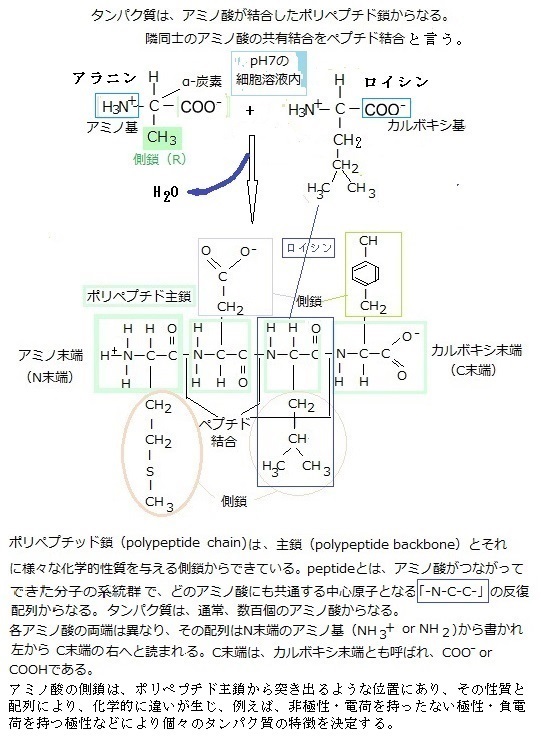
アミノ酸分子のアミノ基-NH2またはNH3と、他のアミノ酸のカルボキシル基-COOHとから、水1分子H2Oが取れて縮合してできる形-CO-NH-の結合形式である。
必須アミノ酸 バリン・イソロイシン・ロイシン・メチオニン・リジン(リシン)・フェニルアラニン・トリプトファン・スレオニン(トレオニン)・ヒスチジン。
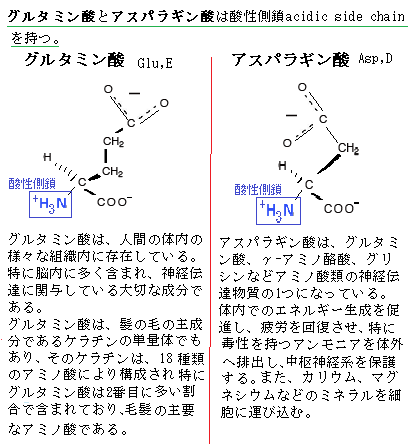
非必須アミノ酸 アルギニン(アルギニンは小児では必須アミノ酸に含まれる)・グリシン・アラニン・セリン・チロシン・システイン・アスパラギン・グルタミン・プロリン・アスパラギン酸・グルタミン酸。
目次へ
 水中の水素イオン(H+)を、水中から取って結合する性質を塩基性と呼ぶ。そういう性質を持った基を塩基性基と言い、塩基性基を持った物質を塩基性物質と言う。
水中の水素イオン(H+)を、水中から取って結合する性質を塩基性と呼ぶ。そういう性質を持った基を塩基性基と言い、塩基性基を持った物質を塩基性物質と言う。塩基性物質が溶けた水は塩基性、即ちアルカリ性を示す。アミノ基(-NH2)は、プラス荷電を帯びたH+を受取り、プラス荷電を帯びた-NH3になり塩基性基になる。アンモニアガスNH3は、水に溶けると-NH4になる塩基性物質になる。
逆に、水素イオンを水中に放出する性質を酸性と言う。そういう性質を持った基を酸性基、酸性基を持った物質を酸性物質と言う。酸性物質が溶けた水は酸性を示す。
カルボキシ基carboxy group(-COOH)は、プラス電荷のH+を放出して-COO-になり、マイナス電荷を帯びる酸性基である。リン酸(H3PO4)やイオウ(金属元素と化合物を形成し種々の鉱石の主成分となる)などは、そのままでも酸性物質であるが、有機化合物に結合したリン酸基や硫黄基は酸性基になる。
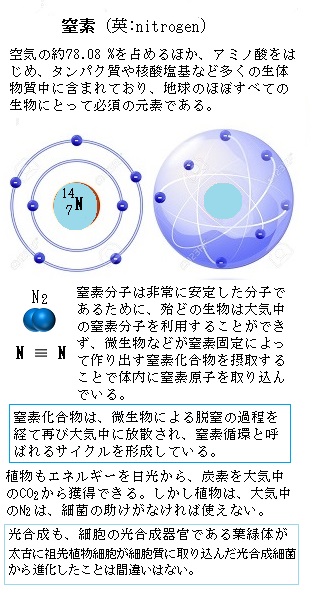
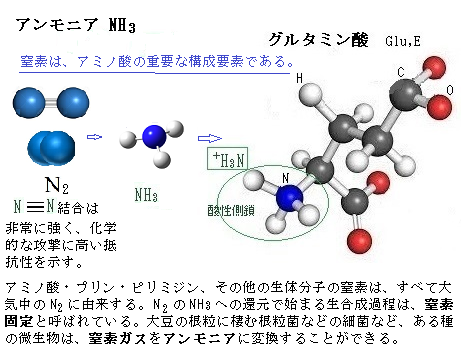
窒素に対するイオウの必要量は植物によって決まっているが、多量要素のイオウであっても、タンパク質の生成や根の発育に不可欠な窒素を効かせるためには、絶対必要な要素である。
陸上植物の細胞内のイオウの殆どは、土壌溶液中からH+-SO42-共輸送体(きょうゆそうたい)で輸送される硫酸イオン(SO42-)に由来する。土壌中のイオウイオンは、多くは岩石の風化で生じた。ところが、工業化は大気中に汚染物質を生み出し、それが供給源となった。化石燃料の燃焼は、種々のガス体のイオウを生じ、この二酸化硫黄(SO2)や硫化水素(H2S)が降雨で土壌に浸み込んだ。
気体の二酸化硫黄は、ヒドロキシルラジカルhydroxyl radical(OH・、水酸ラジカルともいう。酸化力が非常に強い活性酸素の一つ)や酸素と反応して三酸化硫黄(SO3)を生成する。三酸化硫黄は、水に溶解して強酸の硫酸(H2SO4)となり、酸性雨の主要因になっている。
リン酸は多量要素で、酸素と結びついたリン酸の形で植物に吸収される。生物の元素含有量においてもリン酸は多いので、堆肥にも多く含まれている。細胞の核の成分である核酸 (DNA)、細胞膜の成分であるリン酸脂質、エネルギー転換をつかさどるアデノシン3リン酸(ATP)、光合成におけるエネルギーの一時保管、酸化還元補酵素(NADP)など、リン酸の役割は広い。
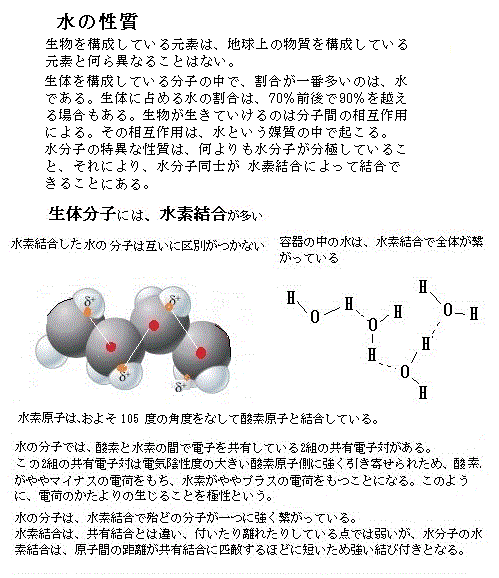
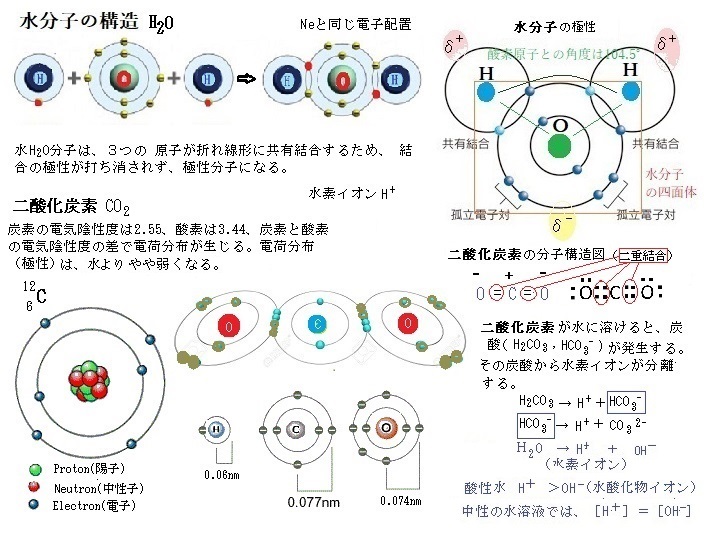
水(H2O)は代表的な極性分子で、他の多くの極性分子と水素結合を作り、その水和によって結合相手の分子の性質をも変える。例えば、生体分子の反応を触媒する酵素の活性は、その水和量に依存している。 純水では、水分子のごく一部が電離して、水素イオンH+と水酸イオンOH-が遊離している。それぞれのモル濃度を、水素イオン濃度[H+]、水酸イオン濃度 [OH−]と記す。
純水はおのずと中性であり、水素イオン濃度と水酸イオンは等しく、25℃では[H+]=1×10−7mol/LであることからpH=7と表記される。この水に酸を加えて、[H+]が10倍になったとき、[H+]=1×10−6mol/LとなりpH = 6、[H+]が100 倍になったとき、[H+]=1×10−5mol/LとなりpH = 5と表記される。このように酸の水溶液の pHは7よりも小さく、この値が小さい水溶液ほど酸性が強くなる。
 温度が一定ならば、水分子のごく一部が電離したH+濃度とOH-濃度の積の値は常に一定、と言う大原則がある。
温度が一定ならば、水分子のごく一部が電離したH+濃度とOH-濃度の積の値は常に一定、と言う大原則がある。そこで塩基性基が水素イオンをムリヤリ引き付けてしまうと、水分子は一定の値を保とうとして、H+が減少した分だけOH-濃度を増やす。
酸性基が水素イオンH+を放出すると、逆にOH-濃度を減らすことになる。
例えば、純水に塩基を加えて、[OH−]が100倍になったとき、[H+]は減って 1/100になる。このとき、 [H+]=1×10−9mol/Lであるため、pH = 9となる。このように塩基の水溶液の pHは7よりも大きく、pHの値が大きい水溶液ほど塩基性が強くなる。
pHを表す式は、水素イオン濃度をモル濃度[H+]で示したとき、 pH = log[H+]-1 になる。 中性では水素イオン濃度は10-7モルなので、pH7になりますが、水素イオンが10倍増えたら、pH=6に、逆に10分の1になるとpH=8と変化する。
現在、簡易水道から比較的大きな浄水場まで、塩素殺菌剤として次亜塩素酸ナトリウムが用いられている。次亜塩素酸ナトリウムは、従来の塩素ガスに比べて安全で、その取り扱いに利便性が高く、上水道などの消毒法として、次亜塩素酸ナトリウム水溶液による殺菌が最も普及している。例えば、液体のため貯蔵設備(薬液タンク)の設置が簡単であり、注入量の調整も容易で、自動制御による精度が高いなど、操作性や管理面からも塩素より優れている。また、殺菌効果の長い残留性が期待でき、残留塩素の測定に便利であるなど、安全性やコストなどの観点からも、塩素投入よりも普及している。
 次亜塩素酸ナトリウムsodium hypochloriteの化学式は NaClO で、次亜塩素酸ソーダとも呼ばれる。英語のSodium“soʊdiəm”は、日本の工業分野では、特にナトリウム化合物をソーダ(曹達)と呼ぶ。ナトリウムnatriumはドイツ語である。
次亜塩素酸ナトリウムsodium hypochloriteの化学式は NaClO で、次亜塩素酸ソーダとも呼ばれる。英語のSodium“soʊdiəm”は、日本の工業分野では、特にナトリウム化合物をソーダ(曹達)と呼ぶ。ナトリウムnatriumはドイツ語である。Hypochloriteとは、「次亜塩素酸(HClO)」を言う。次亜塩素酸ナトリウムの水溶液は、下記の反応で生じる水酸基イオンによりアルカリ性を示す。
NaClO → Na+ (ナトリウムイオン)+ ClO-(次亜塩素酸イオン)
ClO- + H2O → HClO(次亜塩素酸)+ OH-(水酸基イオン)
HClO → OH- + Cl+
水溶液中の次亜塩素酸の反応性が高い理由として、本来、塩化物イオン(Cl-)は安定したイオンであるはずが、次亜塩素酸(HClO)が、水溶液の中で、OH-とCl+にイオン化した際、OH-の酸素に、Clの1つ電子が奪われたため、塩素ラジカル(・Cl)の状態になり、近くにある他の原子の電子を強制的に奪って、元の安定した塩化物イオンに戻ろうとする。
その作用により、細菌やウイルスを構成する原子の電子を奪い、それにより細胞壁や細胞膜を壊し、DNAやRNAの構成する原子を破壊し、細胞組織を壊すことになる。
細菌やウイルス、化学物質などの対象物から電子を奪い、自ら安定した塩化物イオンに戻れれば、電子を奪われた細菌・ウイルスは自らの形を保つことができず、結局、それが細菌やウイルス、ヒトに危険な化学物質による破壊となり、一方では、消臭などの効果として現れる。
次亜塩素酸ナトリウムは、常温でも徐々に自然に分解する。日光特に紫外線や温度上昇により分解が促進される。さらにpH値が低下する酸化により分解が促進され、特にpH=7以下の酸性になると分解反応がはじまり、pH=5より以下の酸性下では急激に塩素ガスが発生するため極めて危険である。pH=5~7の酸性よりの領域では、次亜塩素酸の濃度が最も高くなり強い殺菌力が働く。
次亜塩素酸ナトリウムは、水酸化ナトリウムの水溶液に塩素ガスを通して得られる。不安定なため、通常は水溶液として貯蔵し使用される。水溶液は安定で長期保存が可能であるが、それでも、やがて自然分解し酸素を放って塩化ナトリウム水溶液(食塩水)に変化し、また不均化も発生する。
高濃度の状態ほど分解しやすく、低濃度になると分解しにくくなる。高温や紫外線などにより、分解が加速する。そのため、常温保存では、高濃度の維持は難しい。その一方では、水道水には微量の次亜塩素酸ナトリウムが混ざっているため、直射日光に当てることにより次亜塩素酸を除去して、観賞魚の飼育に比較的適した水にすることもできる。
次亜塩素酸ナトリウム(NaClO)は、一般に水酸化ナトリウム(2NaOH)水溶液に塩素(Cl2)ガスを吸収させて製造される。つまり、塩素の水酸化ナトリウム溶液の中では、塩素臭があり、強酸化性と強アルカリ性化しやすく、腐食性が強い。
2NaOH + Cl2 ⇒ NaCl(食塩) + NaClO + H2O
次亜塩素酸ナトリウムに殺菌力を持たせるためには、水溶液にする必要がある。水溶液はアルカリ性を示す。
水溶液にすると、次亜塩素酸ナトリウムは水と反応して、次亜塩素酸(HClO)と水酸化ナトリウム(NaOH)となる。
NaClO + H2O ⇔ HClO + NaOH
 次亜塩素酸の組成式では、HClO と表されるが、水素原子と塩素原子が酸素原子に結合した構造 H-O-Cl を持つ。薄い水溶液としては存在するが、遊離酸が弱酸のため、次亜塩素酸ナトリウムなどの次亜塩素酸塩水溶液はかなり強い塩基性を示す。
次亜塩素酸の組成式では、HClO と表されるが、水素原子と塩素原子が酸素原子に結合した構造 H-O-Cl を持つ。薄い水溶液としては存在するが、遊離酸が弱酸のため、次亜塩素酸ナトリウムなどの次亜塩素酸塩水溶液はかなり強い塩基性を示す。塩素の場合は、塩酸を生成するが、次亜塩素酸ナトリウム水溶液の場合は水酸化ナトリウムを生成する。従って、液性はアルカリ側となり、pH値を上げる。一方の次亜塩素酸は不安定な化合物で、分解の際、強力な酸化作用を示す発生期の酸素を放出し、塩酸(HCl)に変わる。
HClO + H2O ⇔ HCl +(O)
更に、この次亜塩素酸は水溶液中で、次亜塩素酸イオン(ClO-)と水素イオン(H+)とに解離する。
HClO ⇔ ClO- + H+
このイオン化の程度は水のpH値や水温によって変化する。
残留塩素とは、水中に残存する殺菌力を持った遊離塩素および結合塩素を言う。同じ遊離塩素の中でも次亜塩素酸(HClO)の方が、次亜塩素酸イオン(ClO-)より、はるかに殺菌能力が大きい。
自然水には、アンモニアやアンモニウム化合物を含むことがあり、それらは一般的な浄水場の処理設備だけでは必ずしも取り除くことができない。しかし、遊離残留塩素はこれらと反応して、アンモニアの水素原子を塩素原子で置き換えてクロラミンとする。クロラミンは水のpHの違いによってモノクロラミン(NH2Cl)、ジクロラミン(NHCl2)、トリクロラミン(NCl3)になるが、一般に水道水に含まれるのは、モノクロラミンかジクロラミンである。このモノクロラミンとジクロラミンを結合塩素と言う。
結合塩素は遊離塩素に比べて、1桁ほど殺菌効果が落ちるが、残留効果は長持ちする。ただ、アンモニア性窒素を含む自然水では、塩素剤を添加していくと、最初のうちこそ、塩素の注入量に応じて残留塩素は増加するが、この残留塩素は主に結合塩素であるため、ある点まで達すつと、この結合塩素が遊離塩素によって分解されて、残留塩素が減少し始める。それが極小点に達した時、再度、塩素を投入すると、その量に応じて残留塩素量が増加するという反応がみられる。
 次亜塩素酸ナトリウムの注入には、一般に定量ポンプが用いられる。定量ポンプは、タンク→吸込側配管→ポンプ→吐出側配管→注入点、という一連の流れで行われている。
次亜塩素酸ナトリウムの注入には、一般に定量ポンプが用いられる。定量ポンプは、タンク→吸込側配管→ポンプ→吐出側配管→注入点、という一連の流れで行われている。塩化ナトリウム(食塩)の飽和溶液を電気分解し、次亜塩素酸溶液を作る方法は、塩素系薬剤より生成される次亜塩素酸よりも低い有効塩素濃度で幅広い殺菌力があり、即効性に優れていると言う。殺菌メカニズム・特徴・注意点などは塩素系薬剤とほぼ変わらない。
循環式浴槽では、肺炎を発症させるレジオネラ属菌Legionella bacteriaによる感染症、レジオネラ汚染防止対策として、浴槽水の遊離残留塩素濃度を、通常0.2mg/L~0.4mg/L程度に保ち、かつ最大1.0mg/Lを超えないように務めるなど、適切に管理を行うことが「レジオネラ症を防止するために必要な技術上の指針」(平成15年7月厚生労働省告示)に示されている。使用される次亜塩素酸ナトリウムは、殺菌効果は優れているが、アルカリ泉質やアンモニア成分が多く含まれる泉質などでは濃度管理が困難で殺菌効果が低下する。
塩素殺菌が有効でない泉質では、例えば、鉄・マンガンなどによる酸化作用が働くと、着色現象が生じる。硫化水素(H2S)など還元性物質が多いと、塩素の還元力が奪われ無効化する。pH が9以上のアルカリ泉、4以下の酸性泉では、塩素が無効化する pH領域である。炭酸水素ガスを多く含むと、塩素の添加で強アルカリ性に変化する。フミン酸質などの有機物やアンモニア成分が多いと、結合塩素が生成され、むしろ殺菌効果が減少する。
その一方、カルキ臭やトリハロメタンtrihalomethane(浄水場での塩素消毒の際、水中の有機物と反応して生成される。代表的なものにクロロホルムCHCl3)などの消毒副生成物の問題がある。これらを解決するための方法として、水道法施行規則第17条に記載されている結合残留塩素(残留塩素の種類には、遊離残留塩素と結合残留塩素の2種類があり、結合残留塩素とは、遊離残留塩素とアンモニアが結合して生成される物質)に着目し、結合塩素の一種である、次亜塩素酸ナトリウム溶液と塩化アンモニウムを反応させて生成したモノクロラミン(NH2Cl)を使用する浴槽水の消毒である。モノクロラミンは、すでに米国の給湯・給水系でレジオネラ症発生を抑制している実績がある。
モノクロラミンmonochloramine はアルカリ条件下、次亜塩素酸ナトリウムとアンモニアの反応によって得られる。
素系薬剤の消毒効果は、殺菌力の強い次亜塩素酸(HClO)と、殺菌力がその 1/100 程度に過ぎない次亜塩素酸イオン(ClO-)の比率により決まるが、その比率は pH によっ て変化する。pH6.0 では、約 97%が次亜塩素酸(HClO)で占められているが、pH7.5 では 50%、pH9.0 では 3.1%と激減するため、アルカリ性の温泉水では、塩素系薬剤の効果が著 しく低下する。山間地には、アンモニア含有泉、アルカリ性泉が多く、一方、遊離残留塩素による消毒はアルカリ性の下では消毒効果が著しく低下する。その消毒環境では、モノクロラミンが最も強力と見られている。
水道法施行規則第 17 条第 3 号但し書には、「供給する水が病原生物に著しく汚染されるおそれがある場合、又は病原生物に汚染されたことを疑わせるような生物若しくは物質を多量に含むおそれがある。場合の給水栓における水の遊離残留塩素は、0.2mg/l(結合残留塩素の場合は、1.5mg/l)以上とする」とある。米国EPA(米国環境庁)の定める最大濃度は、モノクロラミン濃度 4mg/l であることから、日本では、1.5~4mg/lの間であれば飲料水であっても安全かつ十分な消毒効果があると見ている。厚生労働科学研究の「健康安全・危機管理対策総合研究事業」において継続して行われているモノクロラミン消毒実証実験では、3mg/lの濃度で遊離残留塩素による消毒に匹敵する十分な消毒効果が得られると判断されている。塩素よりも安定して消費者のもとに届くまで消散することがないモノクロラミンの使用は、増加しつつある。
EPAの報告では、塩素として0.1mg/Lのときの殺菌時間は、水温2~6℃で次亜塩素酸(HClO)を1とすると、次亜塩素酸イオン(ClO-)で80倍、モノクロラミン(NH2Cl)で350倍もの時間を要したと言う。
次亜塩素酸ナトリウムによる殺菌のメカニズムは、その水溶液に分解した残留塩素が細菌や微生物の呼吸系酵素の働きを阻害し、細胞呼吸cell respirationを停止させることにあり、生きている細胞を酸化する事ではないと言う説もある。
細胞呼吸を行うミトコンドリアmitochondria(mitochondria)は、細胞に必要なエネルギーを作り出している。ミトコンドリアは、糖などの食物分子の酸化で得たエネルギーを利用して、ATP(アデノシン三リン酸)を作る。ATPは、細胞の活動の原動力になる基本的な化学燃料である。ミトコンドリアが働くと、酸素を消費し二酸化炭素を放出するので、この化学反応を細胞呼吸と呼んだ。
植物と光合成微生物は、日光のエネルギーを利用して、大気中のCO2と土中の水から炭素と酸素、窒素と化学エネルギーを得て、糖と有機分子と酸素をどんどん作り続ける。これらの分子は、他の生物の食料となる。植物や光合成生物を含む殆どの生物は、O2を用いて細胞呼吸をし、食物分子を酸化し、炭素原子をCO2の形で大気中に放出する。この過程で生物は、呼吸系酵素などを働かせるに必要なエネルギーを得る。 地球の大気には、酸素O2が21%含まれている。酸素の存在下でエネルギー的に最も安定している形は、炭素ではCO2、水素ではH2Oである。それで細胞は、糖などの有機分子の炭素と水素原子を酸素と結合させる酸化をし、それぞれをCO2とH2Oに変えることでエネルギーを獲得する。つまり、熱力学の第二法則の1つの表現である「自然界で自然に起きる反応は、エネルギーの高い状態から低い状態へと発熱反応をする」となれば、その際に放出されるエネルギーを生体内で起こる諸々の動きの原動力として活用できる。この過程を呼吸respirationと言う。
繰り返すが、炭酸ガスや水分子は、有機化合物の中では、これ以上は酸化されない、一番安定した分子で、分子として持つ固有のエネルギーが一番低いレベル状態にある。逆に炭酸ガスが還元されていくと、順に一酸化炭素・蟻酸(ぎさん)・ホルムアルデヒト・メチルアルコール・メタンと並ぶ。還元とは、水素を加えることでもあるから、分子としては、右に行くほど還元された状態となり、その固有のエネルギーがより高く蓄積される事になる。 生物は、呼吸により、糖を分解して得たエネルギーをATPなどの形に変えている。真核生物ではミトコンドリアで、原核生物では細胞膜近辺で行われる。次亜塩素酸ナトリウムによる殺菌のメカニズムは、この付近で作用しているのだろうか。
pH値が、特に重要で、pH値が低いほど、HClOの割合が大きくなり、殺菌力が増す。pH6.0 では、約 97%が次亜塩素酸(HClO)で占められている。pH7.5 では 50%にまで下がる。ここで言うpH値とは、次亜塩素酸ナトリウム注入後の値である。注入後のアルカリ性によるpH値の上昇に留意する理由でもある。
目次へ
茅野市は、標高770メートルから1,200メートルにわたりゆるやかな裾野が広がる高原で、車山山塊や八ヶ岳の山々から育まれた豊富で良質な地下水を水源としている。茅野市上水道事業の水源は、全て地下水であり、浄水方法は塩素消毒及び紫外線処理である。
茅野市の給水状況は、普及率が100%、1日平均給水量は、19,770m3/日、給水区域は、65.3km2、給水人口は、54,034人、給水世帯数は、22,538世帯である。
茅野市上水道事業における給水人口の直近5年間の平均は約53,700人で 横ばい状況であった。また、一日大給水量は平成23年度(2011年度)までは 増加傾向であったが、その後は、減少傾向となる。
茅野市の水源が100%地下水で、河川などの表流水を直接取水している浄水施設はない。水質は良好で水道水に適している。
消毒処理方法は、次亜塩素酸ナトリウムによる。 茅野市の水源は、26ヵ所の深井戸と25ヵ所の湧水、合わせて51ヵ所、配水池は市内49ヵ所ある。
茅野市の上水道水源名称と種別
湧水は、北大塩水源・湯川第1水源・湯川第2水源・上場沢塩之目水源・大沢水源・高部第1水源・高部第2水源・丸内水源・芹ヶ沢第2水源・坂室第1水源・坂室第2水源・ネジクラ水源・一本ザワラ水源・大日向水源・所窪水源・鉄山水源・家前水源・東岳水源・篠八水源・白樺第1水源・白樺第2水源・白樺第4水源・蓼科第1水源・蓼科第2水源・蓼科第4水源の25ヵ所。
深井戸は、横内第1水源・横内第2水源・横内第3水源・横内第4水源・中道第2水源・新井第1水源・新井第2水源・伊勢宮水源・北大塩中区水源・丸山上水源・丸山下水源・出林水源・穴山上水源・大沢第1水源・大沢第2水源・大六天水源・上原山第1水源・上原山第2水源・美濃戸第1水源・美濃戸第2水源・上原山第3水源・湯川第3水源・湯川第4水源・東岳第2水源・白樺第6水源・白樺第7水源の26ヵ所ある。
深井戸は、水中ポンプで地下水 を汲み上げているため動力費が掛かる。配水系ごとの水源の配置を念頭に、動力が掛からない湧水を優先的に取水している。
茅野市上水道の水源は、5箇所の予備水源もあるが、水源別取水量の割合は湧水が60.4%、地下水が39.6%と、湧水が地下水より1.5倍程度上回っている。取水率は、湧水が84.1%、地下水が76.2%になる。
厚生労働省の「おいしい水研究会」が、「おいしい」とした水質要件には、カルシウム・マグネシウム・ナトリウム・炭酸ガスなどが適度に含まれ、有機物や臭気が極めて少ないことなどを挙げている。
茅野市上水道の水道水は、おいしい水の要件に適合している。
美味しい水の要件に適合する茅野市水道水
| 項目 | 指標 | H28年度の平均値 | 備考 |
| 蒸発残留物(ミネラル) | 30~200mg/l | 82 | |
| 硬 度 | 10~100mg/l | 24 | |
| 遊離炭酸 | 3~30mg/l | ― | 検査不要 |
| (PH値) | 7.6 | アルカリ性 | |
| 有機物(全有機炭素の量) | 3mg/l以下 | 0.3未満 | |
| 臭気強度 | 3以下 | 臭気強度のデータはないが、水質試験の臭気項目は 全て異臭味なしであった。 | |
| 残留塩素 | 0.4mg/l以下 | 0.24 | |
| 水 温 | 20度以下 | 18.9 | |
茅野市の配水池は、蓼科第1配水池から蓼科第5配水池と蓼科トヨタ配水池、白樺第1配水池から白樺第7配水池などを含めて49ヵ所に及ぶ。
水道輸送施設は、取水施設から取り入れた水を配水池(浄水場)まで水を運ぶ導水管、浄水を配水池まで水を運ぶ送水管、配水池から水道利用者まで水を運ぶ配水管等の管路施設と、浄水を貯留し配水区域の需要変動を調整する配水池で構成されている。さらに、適正水圧に調整するための増減圧施設も含まれる。
配水池容量は非常時対応容量を考慮して、配水区域の計画一日大給水量の12時間容量を確保している。
配水池容量は、計画一日大給水量(年間の一日当たり給水量のうちの最大値をいう)の12時間分を標準としているが、茅野市上水道事業の配水池容量は13.4時間と、標準より多い状況である。
耐塩素性病原生物は、病原ウイルス・病原菌・病原細菌・病原微生物・病原体などと呼ばれる各種の病原生物のうち、水の消毒に用いられる濃度での塩素に対して大腸菌又は大腸菌群に比較して著しく抵抗性を示すものの総称である。
クリプトスポリジウムCryptosporidiumは、ウシ・ブタ・イヌ・ネコ・ネズミなどの腸管寄生原虫として知られてきたものであるが、ヒトでの感染は1976年にはじめて報告された。クリプトスポリジウムなどの耐塩素性病原生物への対策については、従来、原水に耐塩素性病原生物が混入するおそれがある場合には、浄水施設に濾過設備などが設けられなければならないこととされてきた。しかし、必要な濾過設備が設置されていない施設が、特に小規模な水道施設に多くあることなどから、耐塩素性病原生物対策を一層推進していく必要があった。
近年、最新の科学的知見などを踏まえ、紫外線照射が、クリプトスポリジウムやジアルジアの不活化に有効とされ、濾過と比べ簡便な手法として導入することが勧められてきた。
厚生労働省は、水道施設の技術的基準を定める省令を平成19年3月30日に一部改正し、耐塩素性病原生物対策に紫外線処理を新たに位置づけるとともに、紫外線処理設備が備えるべき要件を定めた。
クリプトスポリジウムは、宿主の組織細胞の内部に寄生したままでその一 生を過ごす寄生性の原生動物(原虫)である。健常なヒトに感染して下痢症の原因となるのは、小腸に寄生する小型のCryptosporidium parvumであり特定の宿主はなく、広い範囲の哺乳動物に感染することが確認されている。無色でほぼ平滑な厚いオ-シスト壁(嚢子壁)で内部が 保護されているため消毒剤に強い耐性があり、不活化されにくい。
茅野市の水道課では、クリプトスポリジウムなどの指標菌が検出されている水源については、水質検査による監視の強化を継続的に行っている。また、浄水処理による対策として、クリプトスポリジウムなどを不活化することができる配水池紫外線処理設備を、米沢北大塩に導入している。
水源の水質保全対策としては、水源地及び周辺の監視強化と保護の推進を行うことで、水源水質の汚染などを防止している。 糞便系大腸菌群「 E.coli 」は、比較的熱や乾燥に弱い細菌であるが、10℃以下の低温でも発育する。人や動物の大腸に生息する常在菌で、食品や河川水などの自然環境に広く分布し、糞便汚染の指標菌である。大部分は病原性を示さないが、一部の菌は腸管に感染し、下痢を主症状とする急性腸炎を起こすことがあり、これらの菌を「病原大腸菌」と言う。
目次へ
 アミノ酸は、アミノ基amino groupとカルボキシ基carboxy groupを持った低分子の有機化合物である。アミノ酸は、1つの分子の中に塩基性を示すアミノ基(塩基性基)と酸性を示すカルボキシ基(酸性基)の両方を持つ電解質electrolyteである。そのため、細胞内の水溶液中では、陽イオンと陰イオンに電離する。水溶液中では、アミノ基(−NH2)は、水素イオンH+(プロトンproton)と結合して−NH3+となり、カルボキシ基はプロトンを解離して-COO-となる。アミノ酸は、その分子の中にイオンになる基を2つ持つため親水性になるはずだが、ロイシンやフェニルアラニンのように疎水性の側鎖が大きくなると水溶性は低くなる。
アミノ酸は、アミノ基amino groupとカルボキシ基carboxy groupを持った低分子の有機化合物である。アミノ酸は、1つの分子の中に塩基性を示すアミノ基(塩基性基)と酸性を示すカルボキシ基(酸性基)の両方を持つ電解質electrolyteである。そのため、細胞内の水溶液中では、陽イオンと陰イオンに電離する。水溶液中では、アミノ基(−NH2)は、水素イオンH+(プロトンproton)と結合して−NH3+となり、カルボキシ基はプロトンを解離して-COO-となる。アミノ酸は、その分子の中にイオンになる基を2つ持つため親水性になるはずだが、ロイシンやフェニルアラニンのように疎水性の側鎖が大きくなると水溶性は低くなる。ポリペプチド鎖は、主鎖main chainあるいは骨格backboneと呼ばれる、アミノ酸が規則的に繰り返される部分と、それぞれに特有な側鎖と呼ばれる可変部分とで構成される。
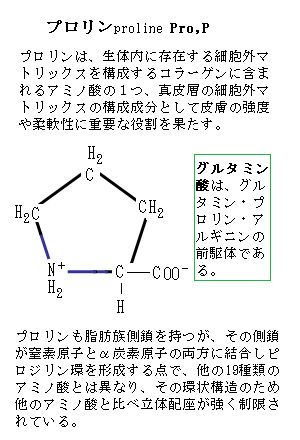
そのポリペプチド骨格は、水素結合(水素とフッ素・酸素・窒素などの電気陰性度の高い原子との共有結合で生じる、比較的大きな極性による強い分子間力)の能力に富み、各残基は水素結合のよい受容体となるカルボニル基carbonyl group(C=O)と、プロリン(アミノ酸の一つ)を例外として水素結合のよき供与体となるNH基を含む。
これらの原子団は、互いにあるいは側鎖の官能基functional group(カルボキシル基 -COOHや水酸基 -OH など)と相互作用をして特定の構造を安定化させている。プロリンも脂肪族側鎖を持つが、その側鎖が窒素原子とα炭素原子の両方に結合しピロジリン環を形成する点で、他の19種類のアミノ酸とは異なり、その環状構造のため他のアミノ酸と比べ立体配座が強く制限されている。
20数種のアミノ酸はアミノ基とカルボキシル基は共通するが、側鎖と呼ばれる部分がそれぞれに違う。側鎖には親水性のものと疎水性のものがあり、これによってアミノ酸も親水性か、疎水性かが決まる。体内の成分は70%が水分、タンパク質は常に水と接する状態にあり、アミノ酸に繋がった側鎖は、通常、疎水性の側鎖は、アミノ酸は内側へ、親水性の側鎖は外側に向かうため、1本の鎖が立体構造になる。疎水性のアミノ酸が水を嫌って内側に潜り、親水性のアミノ酸が水と接する外側に行くからである。
 側鎖が酸性か塩基性かもタンパク質の構造を決める要因となる。塩基性の側鎖はプラス、酸性の側鎖はマイナスのイオンを帯びており、アミノ酸同士は互いに側鎖部分のイオンが引き合ったり、反発し合ったりするため、その立体構造は影響を受ける。
側鎖が酸性か塩基性かもタンパク質の構造を決める要因となる。塩基性の側鎖はプラス、酸性の側鎖はマイナスのイオンを帯びており、アミノ酸同士は互いに側鎖部分のイオンが引き合ったり、反発し合ったりするため、その立体構造は影響を受ける。アミノ酸の種類や数、配列の仕方と並び、その立体構造の形式はタンパク質の独自性を保つ大きな要素となる。たった20数個のアミノ酸から何百億、何兆種類のタンパク質が生まれるのも、これによる。
生化学において四次構造quaternary structureとは、タンパク質の高次構造の一つで、折り畳まれた複数のポリペプチド鎖がお互いに会合した空間配置を言う。ヘモグロビン、DNAポリメラーゼ、イオンチャネルなどや、ヌクレオソームや微小管のように、近年、研究者たちはタンパク質の四次構造を考える時にタンパク質間の相互作用に焦点を当て、タンパク質の集合体は全てタンパク質複合体として考えるようになった。
タンパク質はアミノ酸amino acidが幾つも繋がった直鎖状重合体で、厳密にはアミノ酸が2つ以上繋がっているものがペプチドと定義され、タンパク質との境界線は曖昧である。多くのペプチドが存在する中で、アミノ酸が2つ繋がったジペプチドと、3つ繋がったトリペプチドで、数個から10個連なったものをオリゴペプチド、10個以上になればポリペプチドpeptide bond(共有結合)などとも呼ばれる。加水分解により元のアミノ酸が生成される。
Peptide /péptaid とは、アミノ酸をモノマーとしてペプチド結合によりアミノ酸鎖状につながった分子の総称で、ペプチド結合とは、隣り合ったアミノ酸同士の共有結合をいう。大きなタンパク質では、1,000をはるかに越えるアミノ酸で繋がっている。それでタンパク質をポリペプチドpolypeptide、アミノ酸鎖をポリペプチド鎖polypeptide chainと呼ぶ。
インスリンは、血糖を適正な値に維持するのに重要なタンパク質ホルモンである。ヒトのインスリン分子であれば、どの個体の分子であっても全く同じ構造で、そのアミノ酸配列に違いはない。しかも数千種類に及ぶタンパク質それぞれが、いずれも固有のアミノ酸配列を持っている。自然界に存在するタンパク質の殆どのポリペプチド鎖は、50~2,000からなるアミノ酸残基によって形成されている。最大の単一ポリペプチドは、27,000以上のアミノ酸残基からなる、タイチンtitinと呼ばれる筋肉タンパク質で、この巨大なタンパク質は筋肉の中で大きな輪ゴムのように働く。
 遺伝子の操作技術の画期的な進歩が重なり、今日では殆どのタンパク質を大量に生産できるようになった。それまでは、大量の組織や生体材料、例えば排卵誘発剤であれば、閉経後の女性の尿を集めなければならなかった。近年の目覚ましい遺伝子の操作技術の発展は、特定のタンパク質を研究していた生化学の研究を促進しただけでなく、バイオテクノロジー産業の一分野を誕生させた。今日では、細菌・酵母・培養哺乳類細胞を活用し、インスリンやヒト成長ホルモン、体外受精を受ける女性の排卵を進めるに必要な排卵誘発剤など、治療に必要な様々なタンパク質が大量に生産されるようになった。
遺伝子の操作技術の画期的な進歩が重なり、今日では殆どのタンパク質を大量に生産できるようになった。それまでは、大量の組織や生体材料、例えば排卵誘発剤であれば、閉経後の女性の尿を集めなければならなかった。近年の目覚ましい遺伝子の操作技術の発展は、特定のタンパク質を研究していた生化学の研究を促進しただけでなく、バイオテクノロジー産業の一分野を誕生させた。今日では、細菌・酵母・培養哺乳類細胞を活用し、インスリンやヒト成長ホルモン、体外受精を受ける女性の排卵を進めるに必要な排卵誘発剤など、治療に必要な様々なタンパク質が大量に生産されるようになった。ポリペプチド骨格polypeptide backboneは、主鎖とそれに様々な化学的性質を与える側鎖(R基とも呼ばれる;R group)から形成されている。このポリペプチド骨格は、どのアミノ酸にも共通する中心原子「N-C-C」が反復配列される。ポリペプチド主鎖から突き出ているアミノ酸側鎖side chainは、主鎖のペプチド形成には関与していないが、各アミノ酸の特性を決め、その性質は、非極性で疎水性のもの、負あるいは正の電荷を持つもの、反応性に富んだものなど様々である。
アミノ酸分子のアミノ基-NH2または-NH3と、他のアミノ酸のカルボキシ基-COOHから、水の1分子が取れ放出されて縮合してできる形-CONH-のペプチド結合peptide bondが生じる。この共有結合は、第1のアミノ酸のカルボキシ基の炭素原子と、第2のアミノ酸のアミノ基の窒素原子との間で電子が共有されてできる。その際に水分子1個が失われるため、ペプチド結合の形成は、縮合反応に分類される。
その両端は、アミノ酸とカルボキシル基と異なることで、ポリペプチド鎖が方向性を持つ。ポリペプチド鎖の始まりはアミノ酸末端とみなされ、慣例により、その配列はアミノ酸末端残基から書かれ、カルボキシ末端までの配列で示される。 この反応のギブズエネルギーGibbs(free) energyレベルでは、平衡状態(∆Gが“0”であれば、その系は平衡状態にあり、正味の変化は起こらない)においても、合成よりも加水分解側に傾いている。そのため、ペプチド結合の生合成には、ギブズエネルギーの供給が必要であるはずが、その一方、加水分解の速度はとてつもなく遅いため、触媒のない水溶液中では、ペプチド結合は、100年近い寿命を持つほどに安定している。そのアミノ酸が連なったペプチドの末端で、自由なアミノ基が残っている側をアミノ末端(N末端N-terminus)、カルボキシル基が残って入り側をカルボキシ末端(C末端C-terminus)と言う。
このようなアミノ酸の繋がりを一次構造と言う。その繋がりが、直鎖状で枝分かれがない一次構造は、遺伝子で決められる。
 一次構造のタンパク質は、二次、三次と、やがてタンパク質複合体の構造を作る機能を増幅させる。
一次構造のタンパク質は、二次、三次と、やがてタンパク質複合体の構造を作る機能を増幅させる。細胞内の小さな有機分子の殆どは、分子量が100 ~1,000 程度で、それには、30個以上の炭素原子を含む有機化合物として存在している。通常、細胞質の溶液中に、遊離状態で存在しながら、様々な役割を果たしている。
重合して細胞のタンパク質・核酸・多糖などの巨大分子の単量体となり、エネルギー源となり、分解され細胞内の代謝径路で他の分子に変換されもする。もともと細胞内の小分子は、多くの役割を担うことが多く、同じ小分子が巨大分子の構成単位になり、エネルギーにもなるなど、多目的な用途に有効利用されている。小さな有機分子自体、細胞内の有機物質の総量の1/10ほどに過ぎない。実は、巨大分子ほどに多くない。それでも、一般的な動物細胞には、1,000種類程度の有機小分子が働いている。
20種類のアミノ酸が10個連なってできるペプチドは2010種類、100個連なっていればタンパク質は、20100種類の可能性が高い。実際、膨大なタンパク質が存在し、無限に近い。一次構造のタンパク質は、二次、三次と、やがてタンパク質複合体の構造を作る機能性を増幅させる。
目次へ
タンパク質proteinは、細胞の形や構造を決定する主要な素材であり、細胞の乾燥重量の殆どを占める。しかも細胞が担う無数の機能の殆どを担っている。
タンパク質の構造と活性が、何十億年という生物進化の過程を物語るように、化学的に、タンパク質と言う分子は、並外れて複雑な構造と、精巧な機能を持っている。タンパク質を構成するアミノ酸の連なりの中で、各アミノ酸が、分子内の異なるものの部分を非共有結合することで、安定した三次元構造を作っている。原子レベルまでタンパク質の構造を理解すれば、タンパク分子の精密な形や働きを規定する仕組みが理解されていくと言われている。
酵素は、特定の分子を包み込んだり、はじき出したりする、特異なでっぱりや裂け目のある複雑な分子表面を介して、細胞内の化学反応を触媒する。細胞内には、何千種類もの酵素が存在している。DNAポリメラーゼと言う酵素は、DNA親鎖を3'→5'方向に読み取り、親鎖と相補的な新しい鎖(娘鎖)を5'→3'方向に延長合成する。
細胞膜に埋め込まれたタンパク質は、チャンネルやポンプを作り、栄養分や小分子の細胞内外への輸送を調節している。細胞が生存し成長するためには、周囲の環境との分子の受け渡しが欠かせない。糖やアミノ酸などの栄養物を受取り、代謝により生じた老廃物は排出する。様々な金属イオンの細胞質内や、細胞小器官の濃度の調整もする。
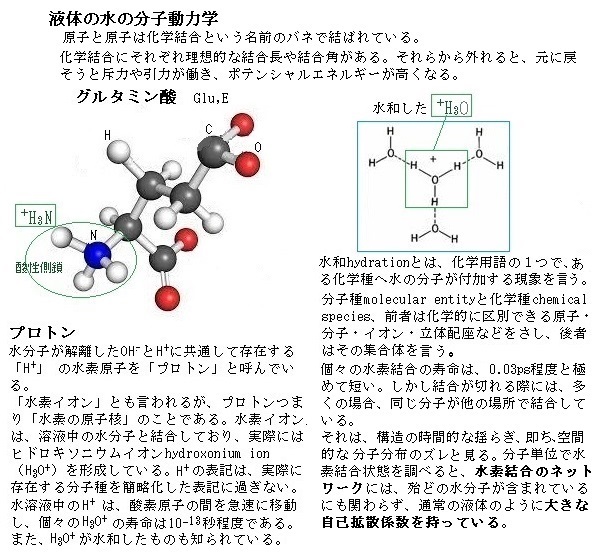
陽子protonは素粒子の一つで、記号 p で表される。正の電荷を持ち、その電荷の大きさは電子と等しい。「プロトン」は水素の原子核の意味で用いられるが、有機化学では水素イオン(H+)の意味で「プロトン」の用語を用いることが多い。そして、「酸とはプロトン(H+)供与体と定義される」。
原子番号1番、陽子(H⁺)1個と電子(e⁻)1個が対になってできた「水素原子(プロトン)」は、宇宙で最初にできた物質でと言われている。プロトンとはギリシャ語で「第1位のもの」、あるいは「根源」という意味がある。 プロトン(H⁺)は、真空の状態以外では、単独では存在し得ないが、水の中で、プロトン(H⁺)は、電子(e⁻)と共に水の中に存在する。水の中に溶けた状態のプロトン(H⁺)は、電子(e⁻)を手放した陽子が、水素イオン(H⁺)として存在している。
原子は正の電荷をおびた陽子と負の電荷をおびた電子の数が等しいため電気的に中性になっている。しかし、何らかの原因で、電子を放出したり、受け取ったりする。結果、原子粒子自体が、電気的に釣り合いがとれなくなり、電荷をおびる。このように電荷をおびた原子や原子団をイオンと呼ぶ。負の電荷をおびた電子を失い、正の電荷を持つイオンを陽イオン、その電子を受け取り負の電荷を持つイオンを陰イオンと呼ぶ。イオン(英; ion)とは、ギリシャ語のἰόνイオン、ローマ字表記のion(going)から、 ion(移動)の名が付けられた。
塩化ナトリウムNaCl(食塩)は水に溶けると、ナトリウムイオンNa+と塩化物イオンCl-に分離する。このように物質がイオンに別れる現象を電離と言う。水などに溶けてイオンに電離する物質を電解質といい、電離しない物質を非電解質と言う。
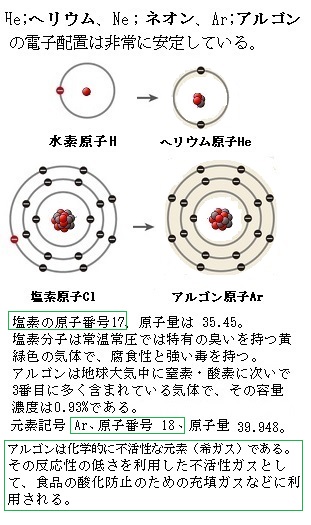 原子は電子を失うと、正の電荷をおびた陽子の数の方が多くなり、原子は正の電荷を帯び陽イオンになる。ナトリウムNaの最外殻には、価電子が1個あり、その1個の電子を失うことにより、陽子が11個、電子が10個となり、電気的に+の電荷が1個多くなり、ナトリウムイオンNa+となる。K殻に2個とL殻に8個の電子がある希ガスのネオンNeと同じ電子配置となり安定する。
原子は電子を失うと、正の電荷をおびた陽子の数の方が多くなり、原子は正の電荷を帯び陽イオンになる。ナトリウムNaの最外殻には、価電子が1個あり、その1個の電子を失うことにより、陽子が11個、電子が10個となり、電気的に+の電荷が1個多くなり、ナトリウムイオンNa+となる。K殻に2個とL殻に8個の電子がある希ガスのネオンNeと同じ電子配置となり安定する。原子が電子を受け取ると、負の電荷をおびた陰イオンになる。塩素Clには価電子が7個あり、1個電子を受け取ると、陽子が17個、電子が18個となり、これは原子全体で陽子より電子の方が1個多い状態となるので、塩化物イオンCl -となる。この塩化物イオンには電子が18個あり、これは希ガスのアルゴンArと同じ電子配置となり安定する。このようにイオンになる場合、希ガスの電子配置になるように電子の受け渡しが行われている。イオンになるときの電子配置は、一番近い希ガスと同じ状態になることが多い。実は、希ガス(He;ヘリウム、Ne;ネオン、Ar;アルゴン)の電子配置は非常に安定している。
カルボカチオンcarbocationとは、炭素原子上に正電荷を持つカチオンのこと、カチオンは陽イオンのことを指す。「正に帯電した炭素」ということになる。
植物細胞に吸収されたカチオンは、有機化合物と非共有結合(金属結合)して複合体となる。 生体中では金属イオン濃度が精密にコントロールされており、種々の生化学・生理学反応に関わっている。しかしながら、金属イオンの内、生体にとって必須な金属イオン、と有毒金属イオンとがある。必須金属イオンには、多量要素であるカルシウム・マグネシウム・カリウムなどの金属イオンや、微量要素である銅・亜鉛・鉄・マンガン・コバルト・ナトリウムなどの重金属イオンがある。有毒金属イオンには水銀・カドミウム・クロムなどがある。生体には必須金属イオンを、貯蔵・運搬・活用し、有毒金属イオンを集積し排出する機構がある。
植物は配位結合と静電結合により、栄養素として要求される種々のカチオンとの同化を促す。特に、根による鉄吸収と同化は重要である。 カチオンと炭化化合物の間で形成される非共有結合には2種類ある。配位結合と静電結合である。配位複合体の形成では、炭素化合物中の数個の酸素原子または窒素原子が、カチオンと非共有結合をする。それによりカチオン上の正電荷は中和される。
配位結合は、主として多価カチオンと炭素化合物の間で生じる。例えば、銅イオンと酒石酸の複合体では、銅イオンは、酒石酸の水酸基の酸素と電子を共有する。酒石酸の化学式はC4H6O6、ワインをつくる際に沈殿する酒石に含まれているので、この名が与えられた。ワイン製造の際に得られる酒石は酒石酸水素カリウムを主成分とする。これを精製して(R,R)-酒石酸がつくられる。食品添加物として認められている。清涼飲料水・果汁・キャンディー・ゼリー・ジャム・ソースなどの酸味料としてクエン酸、リンゴ酸などとともに用いられている。このほかに染料工業、写真、有機合成原料などに用いられる。
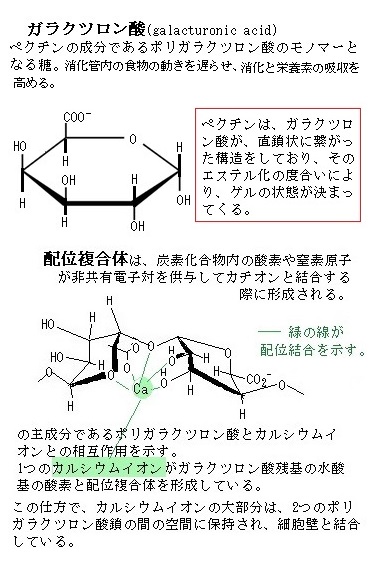
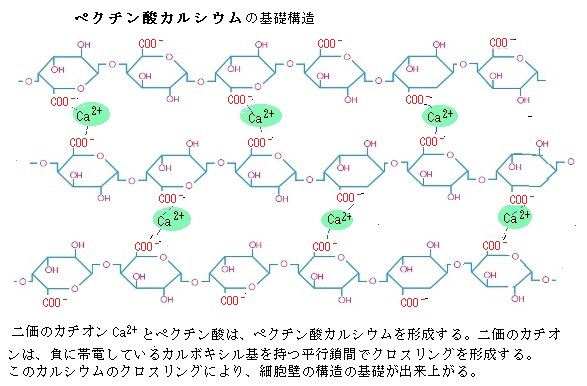
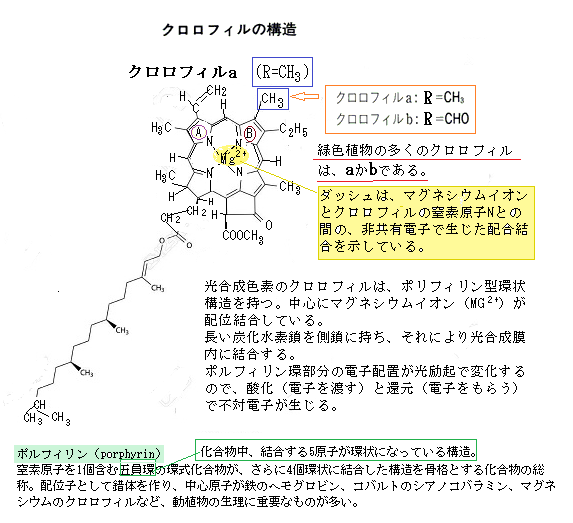 あるいは、マグネシウムイオンとクロロフィルaの複合体もある。配位結合複合体として同化される栄養素には、銅・亜鉛・鉄・マグネシウムイオンがある。カルシウムイオンも、細胞壁のポリガラクツロン酸の複数のカルボキシル基や水酸基との間で配位結合する。
あるいは、マグネシウムイオンとクロロフィルaの複合体もある。配位結合複合体として同化される栄養素には、銅・亜鉛・鉄・マグネシウムイオンがある。カルシウムイオンも、細胞壁のポリガラクツロン酸の複数のカルボキシル基や水酸基との間で配位結合する。カルシウム(Ca)は原子番号 20、原子量 40.08 のアルカリ土類金属元素、ヒトの必須元素である。カルシウムが多い食品は、牛乳・チーズ・小魚・干しエビなどがある。通常、カルシウムは他の物質と結合して存在する。物質が水に溶けて、電気を帯びた原子、原子集団が生じることを「イオン化する」と言う。
例えば、乳酸カルシウムは乳酸とカルシウムイオン、炭酸カルシウムは炭酸とカルシウムイオンが結合している。しかし、カルシウムは、水に溶けると、結合する他の物質と分かれてカルシウムイオンだけになる。
乳酸カルシウム自体は乳由来ではなく、チーズ熟成中の細菌活動により結晶化するが、一般には、砂糖大根(甜菜)などから作る乳酸と石灰石などから作る酸化カルシウムを中和反応させて作る。乳酸カルシウムを水に入れると、カルシウムが水に溶けて見えなくなる。これは、乳酸カルシウムが水に溶けて乳酸イオンとカルシウムイオンに分かれ、目に見えなくなったからである。
 一方、炭酸カルシウムは水に入れても溶けず、炭酸イオンとカルシウムイオンに分かれない。そのため、水に入れても白く濁って見える。
一方、炭酸カルシウムは水に入れても溶けず、炭酸イオンとカルシウムイオンに分かれない。そのため、水に入れても白く濁って見える。 カルシウム(Ca)はイオン化するとプラスイオンになる。Caは20個の陽子(プラス)と20個の電子(マイナス)を持っているので電気的には中性である。これが水に溶けて電子を2個失うことで、マイナスの電荷が減り、その結果プラスの電気を帯びるプラスイオンになる。
地殻中 の存在率が 3.39%、酸素、ケイ素、アルミニウム、鉄に次いで 5 番目の多い元素とされている。カルシウムは動植物にとって欠かせない元素で、哺乳動物ではカルシウムが骨を構成する主成分のほか、神経や細胞内の情報伝達などにも重要な役割を果たしている。
植物ではカルシウムが主に細胞壁の構成成分で、細胞と細胞を強固に結びつけることで植物体を構成する。また、細胞膜の安定化、細胞内染色体の構造維持及び細胞内の新陳代謝で発生した有機酸の中和無害化にも欠かせない成分である。
植物の中にカルシウムが一番多く存在しているのは細胞壁である。細胞壁の構造は、セルロースから構成する微繊維の束が、多糖類や糖タンパク質からなるマトリックと呼ばれる基質に埋め込まれている形である。その基質を構成する多糖類は葉や若枝、果実など若い組織の細胞では主にペクチンで、茎などの固い木質部ではヘミセルロースhemicelluloseが多い。
植物は、発生の初期にはしなやかな細胞壁を作り、その柔軟さにより、細胞壁を伸ばして、新たな構造素材を組み入れるようにする。一般的に細胞壁は、長いセルロース微繊維が、水和した非セルロース性のペクチンとヘミセルロースなどの多糖類(マトリック多糖類とも呼ばれる)と、少量の糖タンパク質に埋め込まれてできる薄い層が、何層か重なった構造からできている。つまり、一次細胞壁は、セルロース微繊維が、ペクチンとヘミセルロースのマトリック(膜内に含まれるコロイド状の水相)に埋め込まれた構造がベースとなる。セルロース微繊維は、細胞の表面で合成され、部分的にヘミセルロースに覆われ、それにより微繊維が互いに離れた配置となる場合がある。ペクチン類は、一体化したマトリックとなり、微繊維間の間隔や間隙率を制御している。この構造により、成長中の細胞壁が、伸びる柔軟性と強度を、同時に併せ持つことを可能にした。
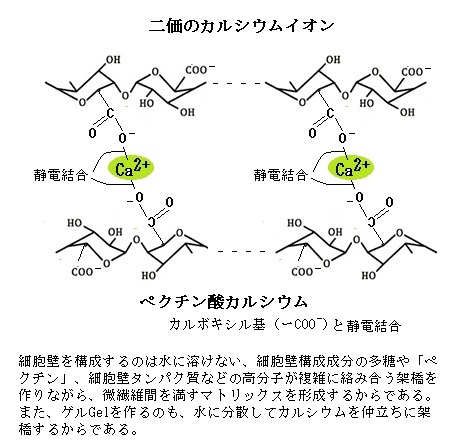
 セルロースと一緒に細胞壁を構成するペクチンpectinとは、ペクチン質またはペクチン性多糖ともよばれる。細胞壁においてペクチンはセルロースの微繊維を固めるほか、細胞と細胞の接着にも
大きな役割を果たしていると考えられている。ペクチンのカルボキシル基(COO-)がカ ルシウムイオン(Ca2+)と結合してペクチン酸カルシウムとなって初めて、ゲル化(膠化;こうか)してマトリック基質となる。
セルロースと一緒に細胞壁を構成するペクチンpectinとは、ペクチン質またはペクチン性多糖ともよばれる。細胞壁においてペクチンはセルロースの微繊維を固めるほか、細胞と細胞の接着にも
大きな役割を果たしていると考えられている。ペクチンのカルボキシル基(COO-)がカ ルシウムイオン(Ca2+)と結合してペクチン酸カルシウムとなって初めて、ゲル化(膠化;こうか)してマトリック基質となる。細胞壁を合成するための素材は細胞の内側から膜交通・分泌という過程を経て供給される。完成された細胞壁は、細胞の外側で、半ば自律的に自分を作り変えることが可能になる。この仕組みで、細胞は自在に細胞壁の形を変えて、大きく成ることができる。成長している細胞の細胞壁は、強靱ではありながら、柔軟にしてダイナミックで、これを一次細胞壁と呼ぶ。植物の成長は一次細胞壁の変化を通して制御されていると言える。
その一方、浸透圧調節や酵素の活性化に関わる殆どのカルシウムイオンは、サイドゾルや液胞の中に遊離している。 植物中のペクチン含有量について、果実類や果菜類(果実を食用とする野菜)、および 3 種の種実類の新鮮物可食部を材料にして行った調査報告によれば、ペクチン の含有率が 0.5%以上のものが多く、クルミやラッカセイのような種実類が 5%以上、柑橘類も 1%以上を有する。乾物で換算すれば、これら植物の可食部の 5~20%がペクチンである。
配位結合 ポリガラクツロン酸は、植物の細胞壁に存在する天然の多糖類「ペクチン」の主成分である。ペクチンは、ギリシャ語の「pectos」、「固い、硬直」に由来する言葉から「ペクチン」と命名された。ペクチンは、水を多量に吸い、細胞をつなぎ合わせる役目を果たす。ペクチンが、細胞壁を構成するのは、水に溶けずに、細胞壁構成成分の多糖やタンパ ク質や細胞壁タンパク質などの高分子が複雑に絡み合う架橋を作りながら、微繊維間を満すマトリックスを形成するからである。また、ゲルGel(液体的な柔軟性を保ちながら、高い粘性を持ち流動性を失い、全体としては固体状になったもの)を作るのも、水に分散してカルシウムを仲立ちに架橋するからである。ペクチンには、HMペクチンとLMペクチンの2種類がある。HMペクチンは、酸や糖の添加によりゲル化する性質を持つペクチンである。ゲル形成には高糖度、低pHの条件が必要である。
LMペクチンは、カルシウムやマグネシウムなどのカチオンと配位結合することで、ゲル化する性質を持つペクチンである。耐熱性の高いゲルであるが、高濃度の糖や酸を必要としない。
 食物繊維は、消化管の酵素によって分解されるタンパク質や脂質、糖質などとは異なり、消化酵素に分解されることなく小腸を経て大腸にまで達する。その食物繊維が持つ働きが明らかになるにつれて、五大栄養素に次ぐ第六の栄養素としてその存在価値が重要視されている。食物繊維は、その性質から「不溶性食物繊維」と「水溶性食物繊維」の2種類に大きく分けられる。
食物繊維は、消化管の酵素によって分解されるタンパク質や脂質、糖質などとは異なり、消化酵素に分解されることなく小腸を経て大腸にまで達する。その食物繊維が持つ働きが明らかになるにつれて、五大栄養素に次ぐ第六の栄養素としてその存在価値が重要視されている。食物繊維は、その性質から「不溶性食物繊維」と「水溶性食物繊維」の2種類に大きく分けられる。セルロースなどの「不溶性食物繊維」は、水に溶けずに水分を吸収して膨らみ、消化物の通過する速度を速めるため、食物に含まれる毒素にさらされる時間を短縮する。その上、乳酸菌やビフィズス菌といった体によい作用をもたらす善玉菌のエサとなり、菌を増やしておなかの調子を整える。
ペクチンなどの「水溶性食物繊維」は、ネバネバとした形状を持ち、胃腸内をゆっくり移動するため、消化管での食物の動きを遅らせ、消化と栄養素の吸収を高める。さらに、吸着性があり、小腸でコレステロールや胆汁酸を吸収して、スムーズに体外に排泄できるようする。
金属イオン(カチオン)の生体中での存在様式には2種類あり、他の原子との静電結合するものと、他の原子と配位結合により位置が固定されているものがある。一般に、マグネシウムやカルシウムイオンなどのカチオンは、アミノ酸やリン脂質、その他の負に電荷した分子との間で、配位結合や静電結合して同化される。カリウム、ナトリウム、カルシウムなどのカチオンの多くは、そのイオン濃度が膜電位を生み出し、神経活動などに関わる。また、カルシウムイオンは細胞内のシグナル伝達においてメッセンジャーとして働いている。他の原子と配位結合しているカチオンは、ヒスチジン・グルタミン酸・システインなどのアミノ酸の側鎖と結合し、タンパク質内部に固定されている。このようなタンパク質は金属含有タンパク質と呼ばれる。
 酵素もその酵素反応を起こす部分にカチオンを含む物が多く、カチオンを介して酵素反応を行っている。一方、血中の酸素を運搬するタンパク質のヘモグロビンには鉄イオンが含まれ、その鉄イオンに酸素が結合することで酸素が運搬される。
酵素もその酵素反応を起こす部分にカチオンを含む物が多く、カチオンを介して酵素反応を行っている。一方、血中の酸素を運搬するタンパク質のヘモグロビンには鉄イオンが含まれ、その鉄イオンに酸素が結合することで酸素が運搬される。過剰な無機物が存在する土壌を塩類土壌と呼ぶ。その土壌にある塩は、一般的には塩化ナトリウムと硫酸ナトリウムである。無機イオン濃度が高まり、養分としての適切な濃度範囲を超えると、植物の根からの吸水が阻害され、その生育が妨げられる。
無機イオンの過剰害に関連するもう1つの重要な問題が、亜鉛・銅・コバルト・ニッケル・水銀・鉛・カドミウム・銀・クロムといった重金属の土壌中への蓄積である。重金属はヒトと同様、植物にも強い毒性を示す。
植物は、根から分泌した有機酸によって、有害な金属イオンを溶脱することで、植物の生育に有利な環境を作る一方、必要とする元素を、栄養素として利用しやすくする。それにより発根が促進される。
その植物の耐塩機構は複雑で、新たな化学物質の生合成や酵素の誘導、膜輸送なども行う。また、植物種によっては、過剰な無機イオンを吸収せずに根から排出したり、スターチスやイネ科のシバなどは、取り込んでも葉にある塩類腺salt glandを通して排出したりする。さらに、無機イオンがサイトゾルに蓄積するのを防ぐため、多くの植物は液胞に隔離する。
細胞や細胞内の小器官は、生体膜という脂質二重層からなる膜によって仕切られている。親水基と疎水基の両端を持つ両媒性の脂質の2分子が、親水性の頭部を外側に、疎水部を内側で疎水結合さ せる2段配列を脂質二重層と呼ぶ。この膜をを構成する脂質分子やタンパク質分子は、、もともと小胞体で合成されたものである。
動物の細胞内は、タンパク質などの細胞質でぎっしり満たされているが、植物細胞の中身の殆どは、やがて液胞となる。成熟した植物細胞では細胞内体積の95%以上は液胞によって占められている。液胞も植物の成長に伴い成熟するので、分裂組織の細胞には、強大な中央液胞が未だない代わるに、多くの小さな液胞や液胞膜が複雑に入り組んだ構造になっている。細胞が成熟にするにつれ、小さな液胞同士が融合し、巨大な中央液胞を形成する。時には、同一細胞内に、2以上の巨大な中央液胞が存在する。
植物のエネルギー源の大本をたどれば太陽光エネルギーだけとなる。そのために、液胞の中に水と溶質からなる液胞液vacuolar sapを、サイトゾルの代わりに満たすことによって、細胞内に不要な小器官を設けず、消費するエネルギーを節約し、なおかつできるだけ自分の体の体積と表面積を拡大し、太陽光が浴びる面積を広げようとする。これを液胞の空間充填機能と言う。
植物の液胞の機能は複雑で、それを一概にまとめることは未だ難しい。例えば、植物のある種の花弁の細胞には、色素を含む液胞と、含まない液胞の2種類が存在するなど、解けない疑問が多い。
液胞は、細胞の空間を充填する役割に加えて、草食動物に対する防御的化学物質を、非毒性の水溶性糖抱合体として貯蔵する。毒性のある二次代謝産物を蓄える際に、それを糖と結合させることにより、その化合物を非毒性化し、しかも水に溶けやすくする。
タンポポ・ケシなどある種の植物に見られる、乳液を分泌する細胞が集まって形成される植物の乳管laticiferを構成する細胞は、気体にさらされると凝固する、乳白色の乳化する液体を生産する。この液体をラテックスlatexと呼ぶことが多い。その構成成分は複雑であることが多く、防御物質を含み毒性か忌避性の二次代謝産物であるが、糖やタンパク質を含むこともある。
キョウチクトウやキョウチクトウ科の多年草トウワタ(唐綿)は、かなりの量の有毒なカルデノリドcardenolideを含むラテックスを乳細胞で生産する。これらの有毒なステロイドの活性は、高濃度であれば心肺停止の危険が高まり、脊椎動物の脳で嘔吐を誘発する神経中枢を活性化する。植食性昆虫は、これらの物質に反応し忌避するか、食して死に至るしかない。北米地域に生息するオオカバマダラ(大樺斑)は、メキシコに向けて「越冬の大移動」をするが、その食草で有名なのがトウワタで、その毒を体に取り込み、鳥などの天敵から身を守る。
カルデノリドは、植物自身にも毒性を持つ可能性がある。組織が損傷して漏洩した際に備えて、毒に弱い組織を防御するために、液胞のような貯蔵用オルガネラや樹脂道resin duct、乳管あるいは腺毛glandular trichomeなど、特殊な形をした構造体に、毒性のある二次代謝物を蓄積しているようだ。植食性昆虫や動物、または病原菌に侵されても、毒素は損傷部位だけに滲出し、重要な成長部位に及ばないようにしている。
殆どのカルデノリドや関連する毒性ステロイドは、糖が結合した化合物・配糖体(グロコシドglycoside)として乳液中に豊富に含まれいるが、液胞など植物細胞の 無機イオンや糖、有機酸や色素などは、液胞の溶質の中ではごく一部でしかない。特に、プロテインボディprotein bodyと呼ばれるタンパク質貯蔵型液胞が、種子には多く含まれている。この液胞内の溶質の多様性は、液胞膜に存在する多種類の特異的な膜輸送体membrane transport proteinの働きによる。
適応能力が発達しているのが雑草だ。植物が極限環境に耐えられるか否かは、遺伝的適応と馴化の両方が関与する。ヒ素に耐性のあるシラケガヤの集団では、遺伝的適応により、ヒ素の吸収が低減されるが、完全に停止できるわけではない。その後もヒ素は、ある程度蓄積されている。
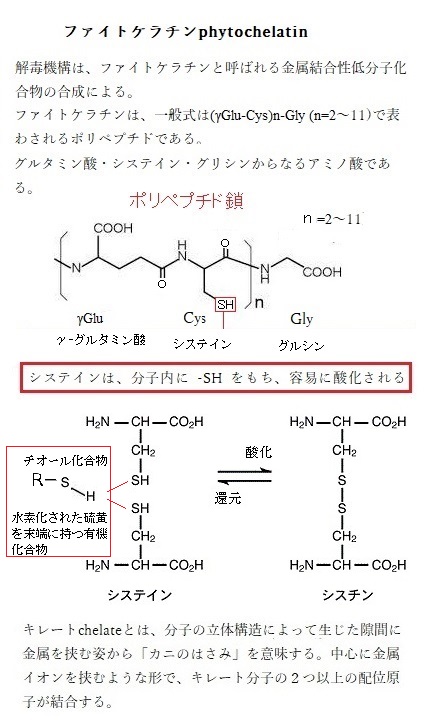 ヒ素に適応したシラケガヤ(白毛茅;牧草として導入されたものが、野生化して日本各地に広がったヨーロッパ原産の帰化植物)は、生化学的メカニズムを用いて、組織中に蓄積されたヒ酸の毒性を軽減する。この解毒機構は、金属結合性低分子化合物であるファイトケラチンphytochelatinの合成による。ファイトケラチンは、ファイトケラチン合成酵素phytochelatin
synthaseによって合成される低分子のチオール化合物で、アミノ酸のグルタミン酸・システイン、及びグリシンからなる。
ヒ素に適応したシラケガヤ(白毛茅;牧草として導入されたものが、野生化して日本各地に広がったヨーロッパ原産の帰化植物)は、生化学的メカニズムを用いて、組織中に蓄積されたヒ酸の毒性を軽減する。この解毒機構は、金属結合性低分子化合物であるファイトケラチンphytochelatinの合成による。ファイトケラチンは、ファイトケラチン合成酵素phytochelatin
synthaseによって合成される低分子のチオール化合物で、アミノ酸のグルタミン酸・システイン、及びグリシンからなる。ファイトケラチン及びその他のキレート剤は、有毒金属イオンの内部耐性に貢献する。キレートとは、特定のイオンとキレート分子の少なくとも2つの配位原子で結合する。キレート分子は、イオウや窒素、酸素などの配位に必要な異なる原子を持っており、これらの原子はキレートするイオンに対して異なる親和性を持っている。金属キレート分子ファイトケラチンは、システインのイオウ原子を介して、ヒ素・カドミウム・亜鉛などの金属イオンをキレートする。そのイオンをキレート分子が包むように錯体を形成することで、イオンの化学的活性をより低めてイオンの潜在的毒性を低下させる。通常、その錯体は元の場所から他の場所に運ぶか、細胞質から排除する。典型的なのは液胞などへ移動させる。
ヒ素汚染鉱山廃棄物の環境で生育するために、シラケガヤが、耐性集団特異的な遺伝的適応と馴化の双方を獲得した典型例と言える。 キレートchelateとは、分子の立体構造によって生じた隙間に金属を挟む姿から「カニのはさみ」を意味する。中心に金属イオンを挟むような形で、キレート分子の2つ以上の配位原子が結合する。配位結合とは、形成する2個の原子の一方のみから、結合電子が供与される結合のことで、その化合物となる配位結合は、多くの錯体にその例がみられる。
錯体とは、金属または金属類似元素の原子・イオンの周囲に、配位子と呼ばれる原子・イオンまたは原子団が立体的に結合し、一つの原子集団を作る立体的分子構造を呼び、この結合の中核をなす配位子をキレート剤と言い、それにより形成される環構造をキレート環と言う。
ファイトケラチンphytochelatinは、一般式は(γGlu -Cys)n-Gly (n=2~11)で表わされるポリペプチド(アミノ酸の鎖)である。γGluはγ-グルタミン酸、Cysはシステイン、Glyはグルシン、生物に対するカドミウムや水銀などの毒性の重金属を捕捉し無毒化する。このファイトケラチンを合成する酵素が、ファイトケラチン合成酵素で、主に植物や一部の微生物、藻類が合成する低分子のチオール化合物で、グルタミン酸・システイン・グリシンからなるアミノ酸である。重金属とキレート化合物を形成すれば、その重金属を無毒化できる。このチオール化合物は、ファイトケラチン合成酵素PCSによって合成される。植物や一部の真核微生物などに存在する。この酵素は、カドミウムなどの有害金属によって活性化し誘導合成され、細胞内でその濃度を上昇させる。
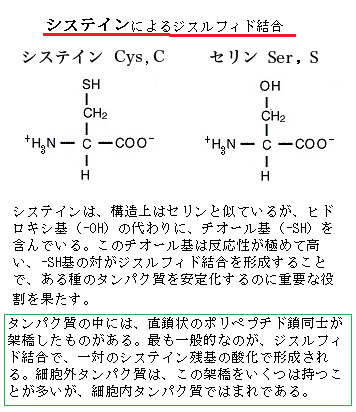
 システインは、構造上はセリンと似ているが、ヒドロキシ基(-OH)の代わりに、チオール基(-SH)を含んでいる。このチオール基は反応性が極めて高い、-SH基の対がジスルフィド結合を形成することで、後述されるように、ある種のタンパク質を安定化するのに重要な役割を果たす。チオールは
R−SH(Rは有機基質)であらわされる構造を持ち、官能基として呼称される場合は、そのままチオール基(-SH)と呼ばれる。カドミウムはSH残基(システイン残基)と結合する性質があり、ファイトケラチンのSH残基がカドミウムと結合し、カドミウムの毒性を軽減する。
システインは、構造上はセリンと似ているが、ヒドロキシ基(-OH)の代わりに、チオール基(-SH)を含んでいる。このチオール基は反応性が極めて高い、-SH基の対がジスルフィド結合を形成することで、後述されるように、ある種のタンパク質を安定化するのに重要な役割を果たす。チオールは
R−SH(Rは有機基質)であらわされる構造を持ち、官能基として呼称される場合は、そのままチオール基(-SH)と呼ばれる。カドミウムはSH残基(システイン残基)と結合する性質があり、ファイトケラチンのSH残基がカドミウムと結合し、カドミウムの毒性を軽減する。残基residueとは、ペプチド結合(アミノ酸同士の結合は、水分子を一個失うことで完成される)で連結された一連のアミノ酸、つまりポリペプチドを形成する単量体に相当するアミノ酸の単位を呼ぶ。
リン酸イオンや鉄イオンの多くは、土壌鉱物や土壌中の腐植酸などにキレート結合(錯体)したり、不溶性になったりして、多くは吸収されにくいため、リン酸欠乏や鉄欠乏になりやすい。根から分泌されたクエン酸やリンゴ酸などは、これらのリン酸イオンや鉄イオンと錯体を形成し、遊離可溶化して吸収されやすくする。また、イネやムギなどのイネ科の植物は鉄欠乏におちいると、大量のムギネ酸という有機酸を分泌し、鉄を可溶化し、キレート化によって体内に吸収して鉄欠乏を回避する。
CO2やO2など幾つかの分子は、細胞膜の脂質二重層を拡散によって透過できるが、大部分は二重層を貫通する通路を作り、特定の水溶性小分子の膜を透過させる膜輸送タンパク質membrane transport proteinの助けを借りる(membrane=細胞膜)。この選択的輸送には、様々な輸送タンパク質が協働し、特定の分子を能動的に細胞外へ排出したり、逆に細胞内に取り込んだりする。結果、細胞質や細胞小器官などの膜内には、特定の溶質だけが選ばれて溜まることになる。
細胞間の情報伝達や、細胞内の因子が次々にシグナルを受け渡し、その工程が進むにつれ、関与する酵素や分子の数が増大していく。最終的には細胞の機能変化や核内の転写因子による特定遺伝子の転写調節因子や、アポトーシスによる細胞死などを起こすシグナル伝達系のタンパク質も生じる。
細胞質で細胞小器官を動かすモーターとしてのタンパク質や、正確に調整された可動部を持つ微少な小分子装置の部品として機能する抗体や、様々な生理機能の調整にかかわるホルモンの多くもタンパク質である。
 低温環境下に生息する魚や昆虫、植物・微生物などから見つかっている不凍タンパク質antifreeze protein、また日本各地の沿岸にも見られオワンクラゲは、刺激を受けると生殖腺がリングのように緑色に発光する緑色蛍光タンパク質green
fluorescent proteinや、ムラサキイガイ(紫貽貝;一般にはムールガイ)などの海洋生物には、海水中の岩にしっかりと接着するタンパク質を持つ。ムール貝の接着性タンパク質のアミノ酸の組成についても調べられ、10個ほどのアミノ酸配列が75回以上も繰り返されて接着性タンパク質が作られていることが明らかになった。ムール貝が出す「接着剤」は足糸(そくし)という糸状の分泌物で、表面が乾いているか濡れているか、材質が有機化合物であるか無機化合物であるかかにかかわらず、ほぼあらゆるものに付着できる。このように独特な機能を持つタンパク質も珍しくない。
低温環境下に生息する魚や昆虫、植物・微生物などから見つかっている不凍タンパク質antifreeze protein、また日本各地の沿岸にも見られオワンクラゲは、刺激を受けると生殖腺がリングのように緑色に発光する緑色蛍光タンパク質green
fluorescent proteinや、ムラサキイガイ(紫貽貝;一般にはムールガイ)などの海洋生物には、海水中の岩にしっかりと接着するタンパク質を持つ。ムール貝の接着性タンパク質のアミノ酸の組成についても調べられ、10個ほどのアミノ酸配列が75回以上も繰り返されて接着性タンパク質が作られていることが明らかになった。ムール貝が出す「接着剤」は足糸(そくし)という糸状の分泌物で、表面が乾いているか濡れているか、材質が有機化合物であるか無機化合物であるかかにかかわらず、ほぼあらゆるものに付着できる。このように独特な機能を持つタンパク質も珍しくない。タンパク質が多様な機能が果たせるのも、様々な形が作られるからである。 殆どのタンパク質は、線状の分子としての形状ではなく、空間的に折り畳められた一定の構造を持つ。タンパク質の全体構造の中で、局所的な構造を二次構造と言う。その代表的な例がαヘリックスとβシートである。
αヘリックスは、ひも状の一次構造がらせんを巻いたものである。ヘリックスhelixとは「らせん」のことで、3次元曲線を意味する英語であるが、ギリシャ語が語源で、ラテン語の helice(ヘリケー)を経由して英語となった。αヘリックスは、3.6個ごとに一回転、36個であれば10回転するらせんであるが、上下のらせんにあるペプチド結合同士の間で、-C=Oと-NHの間の水素結合を形成して、右巻きのらせん状の二次構造を作る。らせんに沿って多くの水素結合を伴うため安定し丈夫である。α構造では、コイル状の骨格がヘリックスの内部を構成して、そのアミノ酸の側鎖は、すべてらせんの外側に突き出ている。
アミノ酸のつながりである、ひも状の一次構造のポリペプチド鎖間のNH基とCO基が水素結合しながら、鉛筆を芯にしてそのまわりに針金を巻き付けてできたような「αらせん」を二次構造として作る。「αらせん」の方向とは、らせん構造の中心軸を見下ろして、時計回りに鎖が回転していれば、右巻きのらせん方向と言う。実際、右巻きヘリックスの方が、側鎖と主鎖の間の立体障害が少ないため、エネルギー的に有利であるため、タンパク質に見いだされるすべての「αらせん」は右巻きである。
プロリンがNH基を持たない環状構造であるため、他のアミノ酸のように立体配座になりえないが、タンパク質のαヘリックスの含有量は、0~100%に至るまで様々である。水溶性タンパク質の約25%は、ポリペプチド鎖がループやターンによって連結されたαヘリックス構造である。また、生体膜を貫通する多くのタンパク質にも、αヘリックスが存在する。血漿の中の鉄の貯蔵タンパク質であるフェリチン(鉄に富む電子密度が高いコアを持つ)のアミノ酸残基の75%はαヘリックスを構成している。
顕微鏡で見ると、ポリペプチド鎖が引き延ばされ、鎖と鎖の間が、NH基とCO基の間の水素結合で固められてはいるが、αらせんとは別の構造もあることが分かる。これがβシートと呼ばれるもので、様々なタンパク質に見られる。αらせん、βシートは共にタンパク質の二次構造に分類され、無理のない安定した構造と言われている。
βシートは、その名のように薄い板、または幕のような形状で、そのペプチド結合の繰り返しは、一次構造のアミノ酸の連鎖同士を水素結合させて帯状になっている。その帯同士も相互に水素結合により、薄い層板の二次構造を形成する。これも安定した構造となっている。
βシートを構成する1本のポリぺプチド鎖は、βストランド(β-strand)と呼ばれている。αヘリックスのような密なコイルを形成することなく、むしろ殆ど一杯に引き伸ばされた構造になっている。しかも隣り合うアミノ酸の側鎖は上下交互に位置する。βシートでは、向かい合うように隣接する2つ以上のβストランドは、NH基とCO基の間の水素結合で連結される。向かい合うβストランドは、それぞれが反対方向を向いている「逆方向βシート」と、同一方向を向いている「平行βシート」とがある。典型的な多くのβストランドは4,5本だが、時には10本以上のβストランドから形成されるβシートもある。この場合、βシートは逆方向のみ、平行のみ、両者が混合する場合などがある。βシート構造は、αヘリックスよりも多様で、比較的平だが、殆どはややねじれた形をとる。βシートは、タンパク質にとって重要な構造で、例えば脂質代謝には欠かせない
アディポカ インadipokineと呼ばれる脂肪酸結合タ ンパク質aP2は、脂肪細胞で高発現し、細胞内の脂肪酸と結合して輸送するタンパク質である。また、aP2 はエネルギー代謝にかかわるタンパク質と考えられている。脂肪組織は余剰な栄養を貯蔵する働きだけではなく、アディポカ インと呼ばれるタンパク質を分泌 し、脂肪組織自体や他の臓器の代謝を調節する内分泌組織であり、特に分泌されたアディポカインaP2と呼ぶタンパク質は、肝臓による血糖調節に関与している。
殆どのタンパク質は密な球形を作るが、球状のタンパク質分子表面の近くでは、ポリペプチド鎖の方向を変える折れ曲がり部分があり、βターン(β-turn,逆ターンreverse turn、ヘアピイベンドhairpin bend)と呼ばれ、通常の構成要素から組み立てられる。多くのβターンは、隣接する残基ではなく、2残基目との間で、CO基とNH基間の水素結合が形成される。この相互作用によってβストランドの突然の方向変換を安定させる。この構造をループloopと呼ぶ。ループは、周期的な構造を作らないが、その固定は独特な形を作る。
どのような二次構造を形成するかは、アミノ酸がαヘリックス構造で安定するアミノ酸配列か、βシート構造で安定するアミノ酸配列をするかにあり、特別な二次構造を持たないアミノ酸配列の部分は、二次構造と次の二次構造を繋ぐ役割を果たす。
多くのタンパク質は、このような二次構造を組み合わせてたモジュール(モチーフ)と呼ばれる単位構造を繰り返して、さらに一つのタンパク質が機能的あるいは構造的に特徴づけられる大きな単位として、ドメインを形成することが多い。例えば、DNA合成酵素は一本のポリペプチドでありながら、DNAを合成する働きを持つ部分(ドメイン)と、逆にDNAを分解する働きをするドメインからなっている。
こうしてタンパク質は、全体を立体的にきちんと折り畳み、それぞれが固有の空間的構造作り上げる。この立体構造をコンホメーションconformationと言う。タンパク質を構成するアミノ酸には、疎水性が強い基からなる側鎖を持つものと、親水性の基からなる側鎖を持つものとがある。
細胞の内部や外部は水溶液としての環境にあり、その水は水分子間の水素結合によってネットワークを作っている。通常、疎水基はその構造を、水素結合の介入によって破られないようにするため水中では寄り集まる。実際には、水からの反発によって見かけの引力(疎水基相互の引力)が生じているのだが、疎水基のこの集合を「疎水結合」と呼ぶ。
タンパク質の多くは、アミノ酸の疎水性の側鎖をタンパク質の内部に、親水性側鎖をタンパク質の表面に出しているので、水との親和性が高い。それで高分子でありながら、タンパク質は水溶液中に浮遊できる。ただ、必要に応じて疎水性のアミノ酸からなる側鎖がαヘリックスを作り、表面が疎水性基で覆われる場合もある。膜を貫通して存在するタンパク質では、貫通部分は疎水性アミノ酸がαヘリックスを作り、そのヘリックスの表面は疎水性側鎖で覆われている。これが細胞膜内部の疎水性領域との間で、疎水性同士が親和性を持つので、こう言うタンパク質は、膜を貫通して存在することで安定状態になる。
目次へ
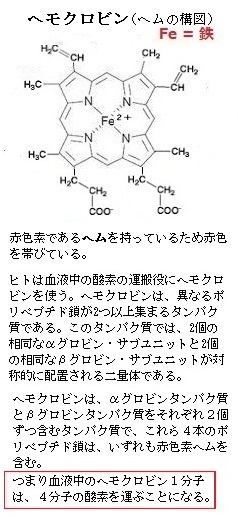
タンパク質は、同じ種類や複数種類のものが、一定の会合状態を作り、機能することも多い。このようなタンパク質の会合を四次元構造と言う。赤血球にあって酸素を運搬する役割を果たすヘモクロビンは、グロビンと言うタンパク質と、ヘムと言う低分子が結合した分子構造になっている。
ヘムは中央に鉄原子を含んだ化合物である。血液が赤いのも、ヘムが赤いからで、グロビンタンパク質の表面には、ヘムが結合するに適した窪みがあり、そこに上手く嵌るようになっている。酸素O2は、そのヘムに含まれる鉄原子に結合して運 ばれる。ヘモクロビンは、αとβの2種類のヘモクロビンタンパク質が4分子集合して機能して、酸素運搬能を高めている。
血流中の血清アルブミンalbuminは、肝臓で合成される小球体から成るタンパク質globular proteinsで、血清総タンパク質の50~70%を占め、体内の栄養や代謝物質と結合してこれを目的地に運ぶ運搬作用と、水分を保持し、血液を正常に循環させるための「膠質浸透圧(こうしつしんとうあつ)」の維持などの働きをする。ここで膠質(コロイド)とは、直径10~1,000A(オングストロームangstrom、10-8cm)の粒子状のアルブミンが水溶液中に分散している状態を言う。
血漿は、血液から血球成分(白血球・血小板と赤血球)を取り除いた液性成分で、EDTAやクエン酸ナトリウム、ヘパリンなどの抗凝固剤の入った採血管で採血後、遠心分離すると血球成分と血漿に分かれる。赤血球・白血球・血小板などの血球成分は、全血の約45%を占め、残りの約55%が液体成分である血漿である。その血漿のうち9割以上が水で、それには、電解質やアルブミン・グロブリン(血清タンパク質 )・フィブリノゲン(糖タンパク質)などのタンパク質、グルコース・アミノ酸・脂質・ビタミン・老廃物・ホルモンなどが溶けている。
 血清は、通常黄色味を帯び透明な液体で、生化学用と呼ばれる抗凝固剤の入っていない採血管で採血される。採血後、転倒混和した採血管を30分間静置し、確実に凝固してから、遠心分離すると上澄みには透明な血清と、下の濃い血の成分の血餅に分離する。血餅は、「血球成分」と「フィブリノゲン」が固まったものである。血清には、血漿の中の血液凝固にかかわる因子、特にフィブリノゲンなどが著しく減少し、血小板やグルコースの濃度も低下するので、主に生化学検査や免疫検査などに用いられる。
血清は、通常黄色味を帯び透明な液体で、生化学用と呼ばれる抗凝固剤の入っていない採血管で採血される。採血後、転倒混和した採血管を30分間静置し、確実に凝固してから、遠心分離すると上澄みには透明な血清と、下の濃い血の成分の血餅に分離する。血餅は、「血球成分」と「フィブリノゲン」が固まったものである。血清には、血漿の中の血液凝固にかかわる因子、特にフィブリノゲンなどが著しく減少し、血小板やグルコースの濃度も低下するので、主に生化学検査や免疫検査などに用いられる。血清が都合がよいのは、血漿に含まれる抗凝固剤のフィブリノゲンが、キレート剤であるアルカリフォスファターゼなどの酵素活性を阻害するほか、幾つかの測定法を阻害する恐れがあるからである。
いろいろな物質と結合する力が強い血清タンパク質であるアルブミンは、カルシウムや亜鉛などの微量元素や、脂肪酸・酵素・ホルモンなどと結合するため、栄養状態を評価する際、低栄養に陥っていないかどうかを調べる指標になっている。その結合力は、アルブミンが分子内の多くの場所でプラスとマイナスに分極しているために生じる。また、アルブミンは周囲の変化に応じて柔軟に分子の構造を変える、構造適応性があり、その分子表面には「つぎはぎの疎水性領域」があることから、それが結合力の原因と考えられている。
アルブミンは、カルシウムや亜鉛などの微量元素や、脂肪酸・酵素・ホルモンなどと結合することでアルブミンの安定度が高まる。例えば、アルブミン1分子は脂肪酸の2分子と強く結合して、アルブミンを更に安定化し、そして、アルブミンは、これらを体内の必要とする目的部位へ運搬する。
また、毒素などと結合して中和する作用などもあり、物質の保管庫(リザーバー)の働きもする。物質がアルブミンと結合することで、その物質の血中濃度が低下する。このため毒物への中和作用が働く。 腸管上皮細胞により取り込まれた化合物は、血流へ移行する。しかし、疎水性化合物や多くの化合物は、血流へ簡単に溶解できるわけではない。これらの化合物は、血清中に豊富に存在するアルブミンのようなタンパク質に結合することで循環系の隅々まで運ばれる。例えば、脂肪酸は水に溶けることができない。遊離脂肪酸は、血中タンパク質であるアルブミンに結合して、エネルギー源としての脂肪酸を必要としている目標の組織に運ばれる。血流中でアルブミンから解離した脂肪酸は、輸送タンパク質の介添えもあって細胞膜を通過して細網内に拡散する。
化合物が血流に達した時、様々に異なる体液や組織に分配される。効果的な薬は、十分な量で標的の部位に達するが、抗真菌薬フルコナゾールは体内に取り込まれた後、脳・心臓・肝臓・脾臓・腎臓・筋肉など他の部位にも分布するため、それぞれの部位での濃度は低下する。薬の担体としての血清アルブミン1分子に、7つの疎水分子が結合している様子が観察されている。
 鉄はヘモクロビンやミオグロビンmyoglobinなどの多くのタンパク質の機能と構造のために不可欠な重要な成分である。しかし遊離の鉄イオンは、フリーラジカルな生成を触媒するので強い細胞毒性を持つ。そのため消化管から鉄を必要とする細胞への鉄原子の輸送は厳密に制御されている。
鉄はヘモクロビンやミオグロビンmyoglobinなどの多くのタンパク質の機能と構造のために不可欠な重要な成分である。しかし遊離の鉄イオンは、フリーラジカルな生成を触媒するので強い細胞毒性を持つ。そのため消化管から鉄を必要とする細胞への鉄原子の輸送は厳密に制御されている。ミオグロビンは、筋肉における酸素運搬体であり、主に心筋や骨格筋に存在する分子量約17,500の153アミノ酸からなる単一ポリペプチド鎖である。おもにαヘリックスから構成されているヘムタンパク質で、そのヘム基は、その内部に殆ど空間が存在しない稠密なタンパク質の裂隙に埋もれている。赤血球中のヘモグロビンにより運ばれてきた酸素を筋組織で受けとり、これを筋組織中で運搬・貯蔵し、エネルギー産生系に供給する。ミオグロビンは極めて密な分子で、その三次元構造の側鎖の分布から統一的な機能分布が明らかになる。その内部の殆どすべてが、ロイシン・バリン・メチオニン・フェニルアラニンなど無極性残基である。内側にある唯一の極性残基、2つのヒスチジン残基が、鉄と酸素の結合に重要な役割を果たしている。
細胞の境界は、タンパク質が脂質の海に浮かんでいる動的な構造である生体膜biological membraneにより形成されている。この膜は細胞内で作られた物質が漏れ出るのを防ぐと共に、不必要な分子が拡散により侵入するのを防ぐ。さらに膜には、特定の分子を取り込み不必要な分子を細胞から除去する輸送系があり、その輸送系により、膜は選択的透過性selective permeabilityと言う重要な機能が加わる。 形質膜plasma membraneと呼ばれる外側の細胞膜に加えて、真核細胞は、ミトコンドリアや葉緑体、多種の分解酵素を含む酸性の小胞であるリソソームやエネルギー変換のための脂肪酸の酸化反応で大きな役割を果たすペルオキシソームなどの細胞小器官との境界を作る内部膜を備えている。そのような区画の発生は、進化の過程における機能の専門化と密接に関連している。特定の系の発展により、選択されたタンパク質を標的にして特定の内部膜を通って特定の細胞小器官へ輸送することが可能になった。
生体膜には、そのほかにも生命に不可欠な、重要なエネルギー貯蔵や情報伝達などいくつかの機能があり、それは膜に結合したタンパク質が担っている。 血液中の鉄はトランスフェリンtransferrinと呼ばれるタンパク質と、非常に強固に結合している。一方、鉄を必要とする細胞は、細胞表面の形質膜にトランスフェリン受容体transferrin receptorを発現している。
鉄と結合したトランスフェリンとトランスフェリン受容体が複合体を形成すると、受容体依存性のエンドサイトーシスが起こり、細胞内にエンドソームendosomeと呼ばれる小胞が形成され、複合体はそのエンドソームに取り込まれる。
膜から出芽する小胞は、細胞質側表面に独自の被覆を持つため被覆小胞coated vesicleと呼ばれる(vesicle;小胞)。被覆には、膜から出芽できる形となり、輸送する分子を取り込むと言う、少なくとも2つの機能を持っている。細胞膜から出芽して細胞内に向かう、タンパク質のクラスリンclathrinからなる外被を持つクラスリン被覆小胞は、細胞膜のクラスリン被覆ピットと呼ばれる部分から出芽する。クラスリン分子が膜の細胞質に面した側に、籠状の網目構造を組み上げ、これが膜を小胞の形に丸める。クラスリン被膜小胞は、選ばれた積み荷分子だけを輸送する。輸送小胞による積み荷の選択の機構が最も解明されているのが、このクラスリン被覆小胞である。
その機能を持つのが、クラスリン被覆を形成する個々の被覆で、それがそれぞれ数個に離脱し、その内腔部分にあった第2の被覆タンパクのアダプチンが、鉄と結合したトランスフェリンとトランスフェリン受容体との複合体を識別して捕らえ、エンドソームに送り込む。
エンドソームが成熟すると、エンドソーム膜のH+(プロトン)ポンプによって、その内腔のpHは、5.5程度に下がり、この酸性環境では、鉄イオンのトランスフェリンへの親和性が低下するので、鉄イオンは遊離し、トランスフェリン複合体はエンドソーム膜のチャンネルを自由に通過し細胞質に移動する。
鉄が離れたトランスフェリン複合体は形質膜に戻り、この複合体が細胞表面に付着する。その血流中の中性pH環境に入ると、トランスフェリンは受容体から離れて再び血流中を循環し、そこでまた鉄イオンを捕らえる過程を繰り返す。トランスフェリン受容体は、そのまま細胞表面に留まり次の取り込みサイクルに関与する。エンドソーム内で解離された鉄はリソソームに送られ、そこから細胞質に輸送される。
細胞は、血液中の鉄イオン濃度が低くすぎても、鉄イオンを効率的に取り入れられている。トランスフェリンと非常に強固に結合している鉄は、トランスフェリン受容体と結合する際に、細胞表面で濃縮され、トランスフェリン受容体を集合させるクラスリン被覆ピット中に集まることでさらに濃縮される。こうして、トランスフェリンにより、血液とエンドソームの間で鉄分子を循環させて、細胞が増殖に必要な鉄を供給している。
トランスフェリンも、主に肝臓で合成される、鉄の貯蔵と運搬に関与する鉄結合性糖タンパクである。その鉄は、小型の鉄貯蔵タンパク質であるフェリチンと結合して肝臓に貯蔵されている。トランスフェリンは、肝臓内に貯蔵されている、腸管から吸収された鉄や、組織から放出された鉄と結合して、血中を運搬し、造血細胞に引き渡す役割を担っている。トランスフェリンは、肝臓でのタンパク質合成能や鉄代謝や造血機能を反映して増減するので、低栄養状態・感染症・肝硬変症・心筋梗塞・悪性腫瘍などと合わせて鉄欠乏性貧血の鑑別診断や治療のモニターとして利用される。
ビタミン
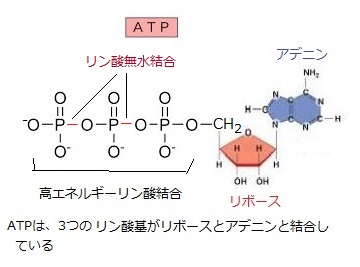 実は、タンパク質の重要な機能の1つが、特定の低分子化合物と結合することで酵素反応を担うことにある。補酵素として働く殆どすべての活性型担体activated carrierはビタミンvitamin由来である。活性型担体の多くは、代謝反応で、エネルギーや化学基の運搬に用いる小分子で、その多くは補酵素として働く。例えば、リン酸基転移が、タンパク質の高次構造のエネルギーを変化させたり、タンパク質の活性を変えるシグナルとして働いたりする際に、ATPがリン酸基の活性供与体となっている。活性型担体からのギブスエネルギーや還元力の流れは酵素が調節する。
実は、タンパク質の重要な機能の1つが、特定の低分子化合物と結合することで酵素反応を担うことにある。補酵素として働く殆どすべての活性型担体activated carrierはビタミンvitamin由来である。活性型担体の多くは、代謝反応で、エネルギーや化学基の運搬に用いる小分子で、その多くは補酵素として働く。例えば、リン酸基転移が、タンパク質の高次構造のエネルギーを変化させたり、タンパク質の活性を変えるシグナルとして働いたりする際に、ATPがリン酸基の活性供与体となっている。活性型担体からのギブスエネルギーや還元力の流れは酵素が調節する。ビタミンは、ある種の高等動物では、摂食の際に少量含まれている必要がある。ヒトは摂食により、少なくとも12種のビタミンを得なければならない。高等動物は、進化の過程でこれを合成する能力を失った。ビタミンの生合成径路は複雑であるため、簡単な分子からビタミンを合成するのに必要な酵素を用意するよりも、摂取する方が生物学的に効率がよい。しかし、ビタミンの不足は、それを必要とする生物すべてに病気を引き起こす要因となる。この生存に不可欠な有機化合物を獲得するために他の生物を犠牲にしなければならない。ビタミンは、殆どすべての生体において同じ機能を果たすが、その機能を発揮する前に修飾される必要がある。
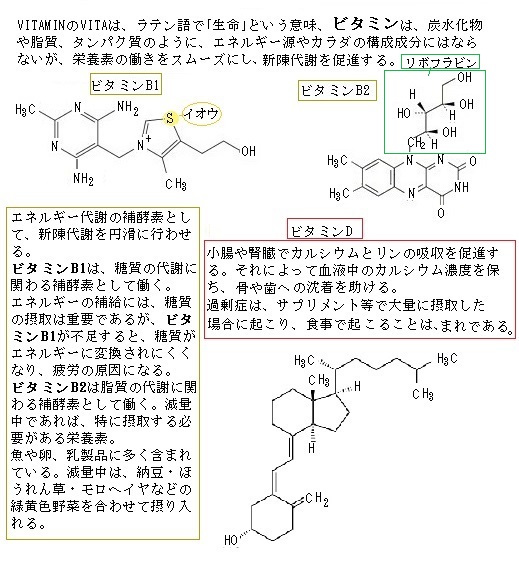 その特定の低分子化合物の身近な例が、ビタミンB1、ビタミンB2、ビタミンB6、ビタミンB12、ビタミンCなど多くの水溶性ビタミンが、数多くの酵素タンパク質と結合して酵素反応を担うため、ビタミンが不足すると酵素の働きが滞り代謝の流れが悪くなる。
その特定の低分子化合物の身近な例が、ビタミンB1、ビタミンB2、ビタミンB6、ビタミンB12、ビタミンCなど多くの水溶性ビタミンが、数多くの酵素タンパク質と結合して酵素反応を担うため、ビタミンが不足すると酵素の働きが滞り代謝の流れが悪くなる。ビタミンB1は、水に溶ける性質を持った「水溶性ビタミン」である。ビタミンB2・B6・B12など8種類存在するビタミンB群が、のちに分離されて単一でないことがわかったが、当初は、緑黄色野菜、果物などに多く含まれていため葉酸と総称した。
ビタミンB1は、糖質を燃やし、エネルギーに変える「補酵素」で、糖質だけではスムーズにエネルギーとして使うことができないので、ビタミンB1欠乏症は、エネルギー産生が障害を受ける結果、全身各種臓器が発症する。
エネルギーを効率よく生み出すビタミンB1は、筋肉疲労を予防・回復する効果があり、その欠乏による初期症状は、疲れや食欲不振などである。欠乏状態が強くなると脚気(体重減少・神経機能障害・心臓障害)やウェルニッケ・コルサコフ症候群(認知機能障害・歩行障害・眼球運動障害)などが引き起こされる。
13種類、すべてのビタミンが補助酵素として働くのではない。ビタミンの名前は、発見された順番もしくは生理作用を表す意味から名付けられた。
ビタミンA・C・D・E及びKは多様な機能を持つ。例えば、ビタミンA(レチノール)は、脂溶性ビタミンの1つで、ロドプシンなどの視物質に含まれる光を感知するレチナールや、重要なシグナル伝達分子であるレチノイン酸の前駆体である。
ビタミンAが不足すると、夜盲症になるが、幼い動物には欠かせない、栄養状態がよくない発展途上国において、子どもたちの失明や発育障害の重大な原因になっている。レチノール活性当量は、動物性食品に含まれるレチノールの量と、主に植物性食品から摂取されるβ-カロテンなどのカロテノイドcarotenoidが体内でビタミンA作用をする場合の換算量との合計で表わされる。
 カロテノイドは、果物や野菜と花などに多く含まれる黄・橙・赤色などの天然色素成分で、これまでに約600種類のカロテノイドが単離同定されている。カロテノイドとは、化学式C40H56の基本構造を持つ化合物の誘導体である。クロロフィルbと同様に、反応中心にエネルギーを集める重要な補助色素であり、秋に黄色や赤色に美しく色づくのは、クロロフィル分子が分解された後にカロテノイドが特に引き立つからである。
カロテノイドは、果物や野菜と花などに多く含まれる黄・橙・赤色などの天然色素成分で、これまでに約600種類のカロテノイドが単離同定されている。カロテノイドとは、化学式C40H56の基本構造を持つ化合物の誘導体である。クロロフィルbと同様に、反応中心にエネルギーを集める重要な補助色素であり、秋に黄色や赤色に美しく色づくのは、クロロフィル分子が分解された後にカロテノイドが特に引き立つからである。ヒトは普段の食生活において、様々な食品からカロテノイドを摂取している。ヒトが摂取して、血中に存在する主要なカロテノイドは、リコペン・α-カロテン・β-カロテン・ルテイン・ゼアキサンチン・β-クリプトキサンチンの6種がある。トマトは特にリコペンが豊富に含まれているから赤い、ニンジンの根にも少量蓄積している。ニンジンやカボチャのオレンジは、大量に含まれるβ-カロテンによる。
ヒトの体内に存在する主要なカロテノイド6種のうち、その体内でビタミンAに変換されるのはα-カロテン、β-カロテン、β-クリプトキサンチンの3つで、近年では、カロテノイドの生理機能に関する研究が大きく進展し、体内でビタミンA作用物質に変換されるプロビタミンAの物質として働く以外に、癌や虚血性心疾患などの生活習慣病の予防効果など、新たな生理機能が次々と明らかになっている。これらに働くカロテノイドは、吸収されると血液の循環によって様々な臓器中に運ばれることが知られている。
癌や心筋梗塞、糖尿病・肝臓疾患など様々な生活習慣病の発症に、酸化ストレスが関与することが多い。カロテノイド類は、その化学構造上に二重結合を多く含むため抗酸化作用が大きく、酸化を防ぐことで、様々な病気の予防に役立つのではないかと考えられている。
カロテノイドは、葉緑体の中で光エネルギーを吸収し、分子間で受け渡し、最後には反応中心にエネルギーを転移する他に、保護機能も果たしている。強い太陽光によって有害な光化学反応が起こる前に、特に酸素に関わる有害反応を抑制するために、この保護機能が働き、主要な色素のクロロフィルが分解され後、太陽光エネルギーが吸収できなくなる晩秋、カロテノイドも失った植物は、光と酸素に触れることで直ぐ枯れる。
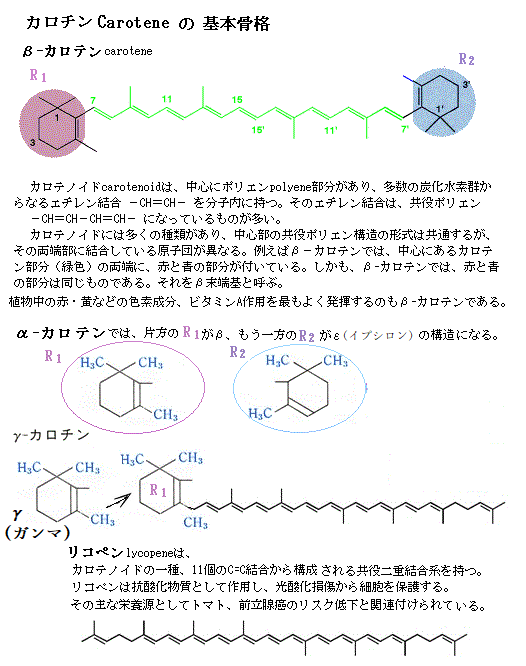 カロテノイドは、果物や野菜と花などに多く含まれる黄・橙・赤色などの天然色素成分で、これまでに約600種類のカロテノイドが単離同定されている。
カロテノイドは、果物や野菜と花などに多く含まれる黄・橙・赤色などの天然色素成分で、これまでに約600種類のカロテノイドが単離同定されている。カロテノイドとは、化学式C40H56の基本構造を持つ化合物の誘導体である。クロロフィルbと同様に、反応中心にエネルギーを集める重要な補助色素であり、秋に黄色や赤色に美しく色づくのは、クロロフィル分子が分解された後にカロテノイドが特に引き立つからである。
ヒトは普段の食生活において、様々な食品からカロテノイドを摂取している。ヒトが摂取して、血中に存在する主要なカロテノイドは、リコペン・α-カロテン・β-カロテン・ルテイン・ゼアキサンチン・β-クリプトキサンチンの6種がある。
トマトは特にリコペンが豊富に含まれているから赤い、ニンジンの根にも少量蓄積している。ニンジンやカボチャのオレンジは、大量に含まれるβ-カロテンによる。
ヒトの体内に存在する主要なカロテノイド6種のうち、その体内でビタミンAに変換されるのはα-カロテン、β-カロテン、β-クリプトキサンチンの3つで、近年では、カロテノイドの生理機能に関する研究が大きく進展し、体内でビタミンA作用物質に変換されるプロビタミンAの物質として働く以外に、癌や虚血性心疾患などの生活習慣病の予防効果など、新たな生理機能が次々と明らかになっている。
これらに働くカロテノイドは、吸収されると血液の循環によって様々な臓器中に運ばれることが知られている。 癌や心筋梗塞、糖尿病・肝臓疾患など様々な生活習慣病の発症に、酸化ストレスが関与することが多い。カロテノイド類は、その化学構造上に二重結合を多く含むため抗酸化作用が大きく、酸化を防ぐことで、様々な病気の予防に役立つのではないかと考えられている。
カロテノイドは、葉緑体の中で光エネルギーを吸収し、分子間で受け渡し、最後には反応中心にエネルギーを転移する他に、保護機能も働いている。強い太陽光によって有害な光化学反応が起こる前に、特に酸素に関わる有害反応を抑制するために、主要な色素のクロロフィルが分解され後、太陽光エネルギーが吸収できなくなる晩秋、やがてカロテノイドも失った植物は、光と酸素に触れることで直ぐ枯れる。
カロテノイド (carotenoid) は、中心にポリエンpolyene部分があり、多数の炭化水素群からなるエチレン結合 -CH=CH- を分子内に持つ。
そのエチレン結合は、共役ポリエン -CH=CH-CH=CH- になっているものが多い。
カロテノイドには多くの種類があり、中心部の共役ポリエン構造形式は共通するが、その両端部に結合している原子団が異なる。
例えばβ-カロテンでは、中心にあるカロテン部分の両端に、末端基の原子団が結合している。しかも、β-カロテンでは、両端の末端基は同じものである。それをβ末端基と呼ぶ。
カロテノイドに多くの種類があるのは、両端の末端基が違うからである。末端基の原子団にβ、ε(イプシロン)などの名前を付けておけば、それぞれのカロテノイドに名前が付くことになる。α-カロテン(α-carotene)では、片方がβ、もう一方がεの構造になっている。
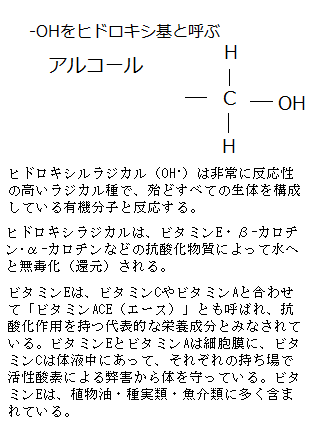
ビタミンC(アスコルビン酸)は、水溶性ビタミンの1つで、抗酸化剤として働く。ヒトを含む霊長類などは、ビタミンCを作る酵素を持たないため、体内でビタミンCを作ることができない。しかし、実験動物として良く用いられるマウスなどほとんどの動物は、ビタミンCを作る酵素を持っている。ヒトの体内のビタミンCは、消費されるほか、水溶性のため尿から体外へ出る。大航海時代の船乗りたちは、長期にわたりビタミンCを摂取しないと、体内のビタミンCが欠乏し、全身の倦怠感や疲労感、食欲不振に続いて、体の各部位からの出血する壊血病を発症し死に至る。また、その抗酸化作用により、有害な活性酸素から体を守る働きをする。
ビタミンCは、自分が酸化されることにより他の物質を還元する。その力により、体内で様々な酵素反応に必要な金属イオンを還元して、酵素反応を活性化する。ビタミンCは、体の細胞と細胞の間を結ぶコラーゲンというタンパク質の一種を作るのに不可欠である。コラーゲンは、骨・軟骨・皮膚・角膜など体内の多くの部位に分布している。ヒトの体内におけるコラーゲンの総量は、全タンパク質の約30%で、皮膚40%、骨・軟骨10~20%、血管7~8%と人体の部位によって割合は異なる。特に皮膚や骨・軟骨などの主成分として繊維構造を作り、組織の形状や柔軟性を保つ役割を担っている。
多くのタンパク質は細胞中で特定の役割を果たしているが、コラーゲンは細胞外で繊維状に存在し、細胞と細胞のすきまを埋める役目を主に担っている。皮膚や骨、腱・軟骨・歯の主要な繊維成分として多く含まれるコラーゲン繊維は、皮膚や骨、血管の強度を保ち、動脈硬化や心疾患を予防する。また、全身に存在していることから、まさに体を形作っている。
この細胞外タンパク質は、長さが約3,000 Å、半径がたったの15Åの棒状分子である。コラーゲンは3本のらせん状のポリペプチド鎖からなり、それぞれ1,000残基近い長さがある。グリシンがアミノ酸配列の3残基ごとに現れ、しばしばグリシンー プロリンーヒドロキシプロリンの配列が繰り返される。コラーゲンの形成異状により、皮膚障害や血管の脆弱性により壊血病になる。ビタミンCの適切な摂取は、粘膜の健康維持や病気などいろいろなストレスへの抵抗力を強め、鉄の吸収を良くするため体内組織を活性化する。
コラーゲンにはⅠ型、Ⅱ型といった合計29種類の分子種があり、それぞれ体内での分布が異なっている。例えば、皮膚や骨にはⅠ型が多く含まれ、角膜にはⅤ型が分布されている。それらを一緒に、その普遍性を前提に、薬効や美容効果を説くことには疑問である。
ビタミンDは、油脂に溶ける脂溶性ビタミンの1つで、摂取するか、日光を浴びて体内にある程度作り出せるビタミンである。ビタミンDの代謝産物は、カルシウムとリンの代謝を調節するホルモンである。ビタミンDは、小腸や腎臓でカルシウムとリンの吸収を促進する働きにより、血液中のカルシウム濃度を保ち、丈夫な骨を作る働きに貢献する。ビタミンDの欠乏は、小児のくる病による筋肉変形と成長障害など成長期の動物の骨形成に異常が起きる。
成人でも骨軟化症により、繰り返す骨折や偽骨折による疼痛や、柔らかく曲がりやすい骨になる。ビタミンD依存性くる病・骨軟化症は、遺伝子の変異により生まれつき発症、骨の痛みや変形などの症状が現れる、指定難病の1つ。ビタミンDを豊富に含む食品は限られており、魚介類・卵類・きのこ類など、中でも魚介類、特に塩さけやしらす干し多い。
ビタミンE(α-トコフェロール)は、ヒドロキシカルラジカルのような活性酸素種を不活性化し、不飽和脂肪酸を含む膜脂質の酸化による細胞障害を防ぐ。フリーラジカルは正常な代謝の過程でも、さらには喫煙や生活習慣や汚染物質のような環境要因からも発生する。
細胞膜を形成する脂質はフリーラジカルによって酸化されやすい。しかし、脂溶性ビタミンであるα-トコフェロールは、フリーラジカルの捕捉に適しており、脂質過酸化の連鎖反応を阻止する。
活性酸素は、非常に強い反応性(酸化力)を持つため、細菌やウイルスに対して強い殺菌力があり、免疫能が高いため、ヒトの体には必須の存在である。その一方で老化の原因になり、万病の元と見られている。ヒトの体には、活性酸素を体内で中和する酸化還元酵素があるため適量ならば問題はないが、多すぎると、非常に強い反応性を持つため、相手構わず攻撃し、タンパク質や脂質、核酸や糖質を酸化させることで病気の原因になり、病気を進行させる。
活性酸素は、肺呼吸から取り込んだ酸素から作られる。体に取り込んだ酸素は血液によって体中に送られ、必要なところに送り込まれた酸素は、細胞内のミトコンドリアで消費される。その際に使った酸素の1~3%程度が活性酸素になると考えられている。激しい運動や、ストレスを受けると活性酸素が大量に発生する。そのため細胞中のDNAまでも損傷されてしまう。さらに血液中のコレステロールや中性脂肪などの脂質と反応すると過酸化脂質となって、血管の壁に貼り付き、血液中の中性脂肪や悪玉コレステロール値が高いと血栓ができ、動脈硬化を発症させる。しかも、血液中の脂質が少なくても活性酸素によって血管が弱る可能性が高い。
ヒドロキシラジカルは、食物に含まれる抗酸化物質で還元し水に変えることができる。ビタミンEが抗酸化物質(還元剤)として働く。
ビタミンEは4種のトコフェロールと4種のトコトリエノールの合計8種の抗酸化物質で構成されている。人体の血液や組織に最も多く存在するビタミンEは、α-トコフェロールである。ビタミンEは脂溶性ビタミンの1つ、抗酸化作用により、体内の脂質の酸化を防いで、細胞膜の酸化による老化や、血液中のLDLコレステロールの酸化による動脈硬化など、生活習慣病や老化と関連する疾患を予防する。その不足は、神経筋障害の原因となる。ビタミンEは、ビタミンCやビタミンAと合わせて「ビタミンACE(エース)」とも呼ばれ、抗酸化作用を持つ代表的な栄養成分とみなされている。ビタミンEとビタミンAは細胞膜に、ビタミンCは体液中にあって、それぞれの持ち場で活性酸素による弊害から体を守っている。ビタミンEは、植物油・種実類・魚介類に多く含まれている。
ビタミンKは、正常な血液凝固には不可欠なタンパク質である。体内に取り込まれたビタミンKは、血液凝固因子の産生に深く関与している。凝固因子は、血液が固まる際には不可欠な物質で、凝固因子が不足すると、外傷などの原因がなくても出血する可能性が出てくる。ビタミンKは正常な止血能を保持するためばかりでなく、骨の成長過程にも重要な物質あると考えられている。
例えば、ビタミンK欠乏症を発症すると、消化管出血・皮下出血・鼻出血・血尿などの症状が見られる。天然に存在するビタミンKは2種類あり、緑黄色野菜・海藻類・緑茶・植物油などに含まれるビタミンK1 (フィロキノン) と、もうひとつは腸内細菌によっても産出されるビタミンK2 (メナキノン)がある。通常の食事をしている人では、ビタミンKが不足することは殆どない。ただ長期間の抗生物質投与により、腸内細菌が撹乱されることにより、ビタミンK欠乏症を引き起こす事例がある。また、ビタミンKの吸収には、小腸や肝臓、膵臓が正常な機能を保っていることが前提であるため、小腸の病気(セリアック病・クローン病・短腸症候群など)や肝臓の病気(原発性胆汁性肝硬変・肝不全など)、遺伝性疾患の嚢胞性線維症(粘稠度の高い粘液が分泌されるため、肺炎・膵炎・腸閉塞などを繰り返す疾患)などがビタミンK欠乏症を誘発する。
食物経由のビタミンKはタンパク質と結合しているため、膵臓から分泌される酵素により切り離される必要がある。その後、肝臓から分泌された胆汁とビタミンKが混合され、小腸から体内に吸収されることになる。
タンパク質はアミノ酸の玉が鎖のように繋がっているように描かれるが、実際はもう少し複雑で、アミノ酸の鎖はらせん状や折り畳まれた形、あるいは球状に丸まった立体構造をしている。タンパク質の立体構造はポリペプチド鎖と呼ばれるアミノ酸のつながりが一次構造、ポリペプチド鎖がらせん状になった二次構造、それがさらに折り畳まれか、球状となる三次構造、球状の鎖がいくつか集まり大きな構造をとる四次構造がある。
長いポリペプチド主鎖における炭素原子を結ぶ共有結合の多くでは、原子が自由に回転できるため自由度が高い。そのためタンパク質は膨大な数にのぼる様々な折り畳が可能になる。ただ、折り畳まれた鎖の形は、タンパク質内に生じる多数の弱い非共有結合の制限を受けている。この非共有結合には、アミノ酸側鎖の原子のみならずポリペプチド主鎖の原子も含まれる。
タンパク質を折り畳み、形を維持する働きをする非共有結合には、水素結合hydrogen bond・静電引力law of electrostatic attra・ファンデールワールス引力van der Waals forceがある。その非共有結合は、共有結合に比べれば格段に弱いので、ポリペプチド鎖内の2つの領域を確実に結合させ、折り畳まれた形を安定的に保つには、多数の非共有結合の組み合わせが大きな原動力になる。むしろ、タンパク質それぞれを特定する三次元構造を安定化させるほど、強力な結合になっているとも言える。
 例えば、DNAの二重らせんの内部では、塩基対は.前の塩基対の上に、次々と重なるように真上に積み上がっていく。重なり合った塩基対相互にはファンデルワールス引力が働き、その二重らせん構造を安定化させている。各塩基対の多くの原子は、ちょうどファンデルワールス半径だけの接触距離を保つ。
例えば、DNAの二重らせんの内部では、塩基対は.前の塩基対の上に、次々と重なるように真上に積み上がっていく。重なり合った塩基対相互にはファンデルワールス引力が働き、その二重らせん構造を安定化させている。各塩基対の多くの原子は、ちょうどファンデルワールス半径だけの接触距離を保つ。第4の弱い力「疎水結合」も、タンパク質の形を決める重要な役割を果たす。水中でのリン脂質による脂質二重層の形成は、迅速に自発的に起こる。それはリン脂質が両親媒性だかである。親水性の極性頭部は、水分子の間で、静電的引力と水素結合による引力が働き層を作り、疎水性の炭化水素尾部は、水分子にはじかれて、二重層の非極性の内部に潜り込む。その上、疎水性炭化水素尾部間でファンデルワールス引力が加わり、尾部はしっかりと中に詰め込まれる。疎水相互作用は、核酸で塩基を積み重ね、水溶液中のタンパク質を折り畳むこともする。
酵素や調節タンパク質の中には、2~4つのタンパク質が会合することで、機能的に働くものが極めて多い。DNAの合成や修復、RNAの合成に関わる調節因子や合成酵素は10種類ある。酵素の複合体が働く場合では、通常、それ以上のタンパク質を集合することが多い。
例えば、細胞質にあるプロテアソームproteasomeと言うタンパク質の分解装置は、約100個のタンパク質が分子量250万個にも及ぶ巨大な複合体を作り、全体としてフタのある樽のような形に集合している。プロテアソームには、数多くのタンパク質の分解酵素が内蔵されている巨大なタンパク質複合体で、組み立てに失敗したタンパク質は、ユビキチン化(タッグが付けられ)され、この分解システムに運ばれ分解される。
ユビキチン
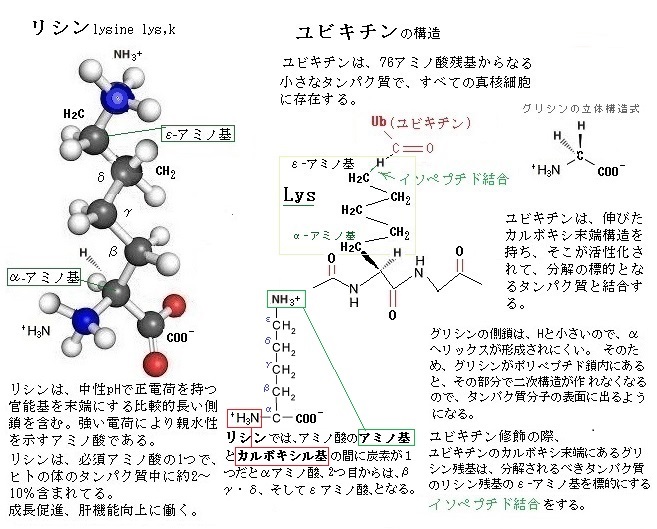 ユビキチンubiquitinは、ATPの加水分解で放出されるエネルギーを用いて、ユビキチンリガーゼという3つの酵素、即ちユビキチン活性化酵素(E1)・ユビキチン結合酵素(E2)・ユビキチンータンパク質リガーゼ(E3)の働きによりタンパク質に共有結合する、76残基のアミノ酸からなる低分子のポリペプチドである。ユビキチンはすべての真核生物に高度に保存され、すべての真核細胞に存在する小さなタンパク質で、分解されるべきタンパク質の目印となる。
ユビキチンubiquitinは、ATPの加水分解で放出されるエネルギーを用いて、ユビキチンリガーゼという3つの酵素、即ちユビキチン活性化酵素(E1)・ユビキチン結合酵素(E2)・ユビキチンータンパク質リガーゼ(E3)の働きによりタンパク質に共有結合する、76残基のアミノ酸からなる低分子のポリペプチドである。ユビキチンはすべての真核生物に高度に保存され、すべての真核細胞に存在する小さなタンパク質で、分解されるべきタンパク質の目印となる。ヒトと酵母のユビキチンの間では76残基の内3残基が異なるに過ぎない。ユビキチンは、伸びたカルボキシ末端構造を持ち、それに含まれるグリシン残基glycine residueが活性化され、分解の対象となるタンパク質と共有結合する。つまり、ユビキチンのカルボキシ末端にあるグリシン残基が、分解されるべきタンパク質のいくつかのリシン残基のε-アミノ基にイソペプチド結合する。
イソペプチド結合isopeptide bondとは、ユビキチンが修飾の際、ユビキチンのC末端カルボニル基とリシンlysine残基のε-アミノ基との間のアミド結合することである。このイソペプチド結合形成のエネルギーは、ATPが駆動する加水分解から得られる。
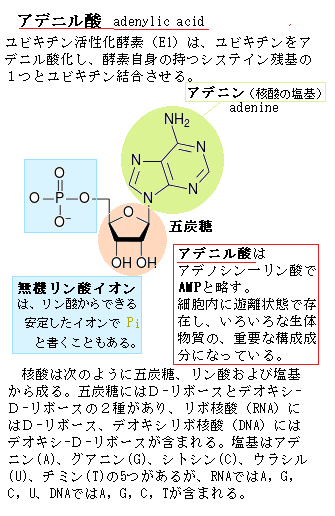
 最初に、ユビキチン活性化酵素(E1)は、ユビキチンのC-末端のカルボン酸残基に含まれるグリシン残基をアデニル酸化し、酵素が持つシスティン残基の1つとユビキチン結合させる。その後ユビキチンは、ユビキチン結合酵素(E2)のシステイン残基へと、E2酵素自身の働きで転移する。最後にユビキチンータンパク質リガーゼ(E3)が、ユビキチンを標的タンパク質上のリシン残基(NH3+)の側鎖であるε-アミノ基に転移させる。ユビキチン化反応では、E3が、標的タンパク質上のリシン残基のε-アミノ基と、ユビキチンのC末端のカルボン酸に結合させることにより、ユビキチン鎖を形成するまで進行する。4個以上のユビキチン分子からなる鎖が、タンパク質の分解の必要性を伝達する有効なシグナルになっている。
最初に、ユビキチン活性化酵素(E1)は、ユビキチンのC-末端のカルボン酸残基に含まれるグリシン残基をアデニル酸化し、酵素が持つシスティン残基の1つとユビキチン結合させる。その後ユビキチンは、ユビキチン結合酵素(E2)のシステイン残基へと、E2酵素自身の働きで転移する。最後にユビキチンータンパク質リガーゼ(E3)が、ユビキチンを標的タンパク質上のリシン残基(NH3+)の側鎖であるε-アミノ基に転移させる。ユビキチン化反応では、E3が、標的タンパク質上のリシン残基のε-アミノ基と、ユビキチンのC末端のカルボン酸に結合させることにより、ユビキチン鎖を形成するまで進行する。4個以上のユビキチン分子からなる鎖が、タンパク質の分解の必要性を伝達する有効なシグナルになっている。タンパク質がユビキチン化される決め手になるのは、分解されるべきタンパク質に存在するテグロンdegronと呼ばれる特定のアミノ酸配列である。それがタンパク質分解のシグナルとなる。タンパク質分解を誘導する「デグロン」配列を、目標タンパク質に直接付加することによりタンパク質を迅速に除去する技術が注目を集めている。
オーキシンデグロンAuxin-Inducible Degron技術では、植物ホルモンの「デグロン」配列を利用して、ヒト細胞のタンパク質に取り付け、その分解が迅速にできるようになった。 タンパク質は、合成と分解、排泄を繰り返し、毎日一定量が新しいものに入れ替わっている。この合成と分解の繰り返しを代謝回転と呼ぶ。この代謝回転により、タンパク質の半量が入れ替わる期間を半減期と言う。肝臓の組織を構成するタンパク質で約2週間、筋肉組織のタンパク質で約180日などといわれるように、それぞれの器官組織で異なる。
ユビキチンを介したN末端則経路は、生体内においてN末端アミノ酸残基に基づいたタンパク質の半減期に関与している。細胞質にあるタンパク質の半減期は、アミノ末端残基に大きく依存している。この依存性をN末端則と呼ぶ。そのシグナルはN末デグロンと言うアミノ酸配列である。
 酵母のタンパク質でN末端にメチオニンmethionineを持つものの半減期は、通常20時間以上である。この位置にアルギニンを持つものの半減期は20分ほどである。N末端にアルギニンやロイシンleucineのような残基があるタンパク質は、非常に不安定であるため、ユビキチン化がしやすく、しかも速まる。メチオニンやプロリンのような残基であれば、タンパク質は安定し、ユビキチン化が難しくなる。メチオニンは、体内で合成されない必須アミノ酸の一つで、側鎖にチオエーテル基thioether(-S-)を含む大きな脂肪族側鎖を持つ疎水性のアミノ酸である。
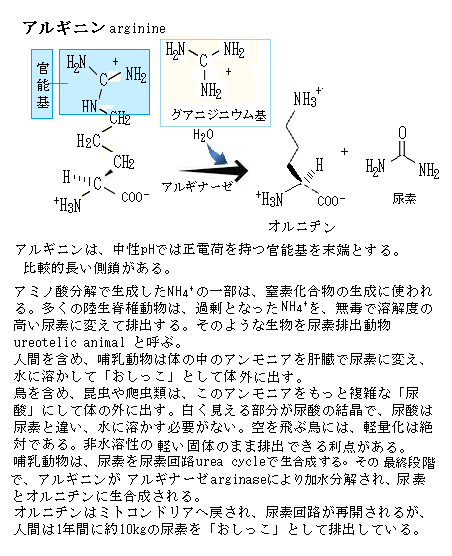
酵母のタンパク質でN末端にメチオニンmethionineを持つものの半減期は、通常20時間以上である。この位置にアルギニンを持つものの半減期は20分ほどである。N末端にアルギニンやロイシンleucineのような残基があるタンパク質は、非常に不安定であるため、ユビキチン化がしやすく、しかも速まる。メチオニンやプロリンのような残基であれば、タンパク質は安定し、ユビキチン化が難しくなる。メチオニンは、体内で合成されない必須アミノ酸の一つで、側鎖にチオエーテル基thioether(-S-)を含む大きな脂肪族側鎖を持つ疎水性のアミノ酸である。アルギニンarginineは、中性pHでは正電荷を持つ官能基を末端にする比較的長い側鎖を持つ。塩基性(水溶液中で水素イオンを受け取り、水酸イオンを生じる物質としての性質、通常、アルカリ性と同義)の化合物のグアニジニウム基を側鎖の末端に持つ。
アルギニンは、難水溶性物質を可溶化する効果があり、アミノ酸を溶かすアミノ酸とも言われている。アルギニンは、脊椎動物における尿素生成のための循環的反応経路であるオルニチン回路ornithine cycle(尿素回路)の一員として、アンモニアの解毒にも関わっている。アミノ酸の一種であるオルニチンに、アンモニアと炭酸ガスが組込まれてシトルリンとなり、ここにさらにアミノ基が加わってアルギニンとなり、アルギニンから尿素 (H2N)2CO が切り離されてオルニチンに戻る。
オルニチン回路の反応は、主として肝臓で進行し、尿中に排出するための尿素生成の生理的意味を持つ。その際、一部のアルギニンから一酸化窒素(NO)が発生する。NOは血管を拡げる作用があり、これによって血流が改善され、血流が悪くなることで起きる症状にも効果があるとされている。さらに、NO産生を通して、免疫細胞がウィルスや病原菌などの外敵を攻撃する力を強めることが知られている。オルニチンとシトルリンは、アミノ酸であるが、タンパク質の構成成分としては使われていない。
より大きな炭化水素鎖は、ロイシン・バリン・イソロイシンisoleucineに見られる。
プロテアソーム
 アミノ酸は、食物として摂取されたタンパク質を、腸が消化することで、あるいは、細胞質内でのタンパク質の分解によって作られる。それにより、生体内の細胞には常に供給され続けられている。多くの細胞内のタンパク質は、変化し続ける代謝の要求に応じて、常に壊されたり、損傷したり、誤って折り畳められたりもしている。そのため、不要のタンパク質が生じる。それを、ただ分解するだけでなく再利用するためのシステムが作られている。
アミノ酸は、食物として摂取されたタンパク質を、腸が消化することで、あるいは、細胞質内でのタンパク質の分解によって作られる。それにより、生体内の細胞には常に供給され続けられている。多くの細胞内のタンパク質は、変化し続ける代謝の要求に応じて、常に壊されたり、損傷したり、誤って折り畳められたりもしている。そのため、不要のタンパク質が生じる。それを、ただ分解するだけでなく再利用するためのシステムが作られている。分解されるタンパク質には、ユビキチンと言う小さなタンパク質の鎖が共有結合され、目印とされてから、プロテアソームと言う大きなATP依存性複合体に送られ分解される。消化や分解を介して生じたアミノ酸の主な用途は、タンパク質合成の単量体となるか、ヌクレオチド塩基などの窒素含有化合物を合成する窒素源なるかであるが、他にも多くの用途がある。
プロテアソームproteasomeは、ATP依存的に、ユビキチン化したタンパク質の分解を行う巨大な酵素複合体である。生命史上最も複雑にして精妙に機能する超分子複合体と言える。プロテアソームは、細胞質で完成した後に核内に運ばれるため、真核生物の細胞質および核内のいずれにも分布している。さらに細胞質や核内のプロテアソームの約半数は、何らかの細胞小器官や転写マシナリー(染色体内のDNAをmRNAにコピーするために必要とされるさまざまな転写因子タンパク質群)と相互作用している。また、プロテアソームは、細胞内タンパク質の恒常性の維持と、細胞周期の進行やシグナル伝達、ストレス応答など様々な生命現象において必須の役割を果たしている。
ユビキチンが死への目印であり、その死刑執行人がプロテアソームである。ユビキチン化は、巨大なタンパク質分解複合体であるプロテアソームproteasomeに認識される部位として働くタンパク質修飾の一種で、ユビキチン化されたタンパク質はよく分解される。プロテアソーム、より正確には26Sプロテアソームと呼ばれる大きなプロテアーゼ(タンパク質分解酵素)複合体が、ユビキチ化タンパク質を分解する。
このATP依存型の複数のサブユニットから構成されるプロアテーゼは、ユビキチンを分解せずに再利用する。26Sプロテアソームは、20S触媒ユニットと19S 調節ユニットの2つの構成因子からなる複合体である。しかも、19S 調節ユニットが2つあって、20S触媒ユニットの上下を挟むキャップとして付いている。
20Sユニットは、14個の遺伝子でコード化されている28のサブユニットから構成され、異なる7個のサブユニッからなる4個の環状構造が重なって、円筒のような構造になっている。円筒の両端にある2個の環は、αサブユニットから構成され、中央にある2個の環はβサブユニットから構成されている。20S触媒コアは、封がされた円筒で、その中への侵入は、それ自身が19個のサブユニットからなる700kDaの19S調節複合体により調節されている。この2つの19S複合体は、核となる20Sプロテアソームコアの両端に結合して、完全な26Sプロテアームを形成している。
19S調節ユニットには、 3つの機能がある。一つ目は、19Sサブユニットは特異的にポリユビキチン鎖だけと結合するため、ユビキチン化されたタンパク質だけが分解される。二つ目が、19Sサブユニット中の、脱ユビキチン化酵素と呼ばれるイソペプチダーゼが、タンパク質から、もとのままのユビキチン分子を切り離すことで、ユビキチン分子は再利用される。
最後に、分解されることが決められたタンパク質は立体構造がほぐされ、触媒コアに送られる。19S複合体の鍵となる構成要素は、6個のAAAファミリーのATPである。AAAは、多様な細胞活動に関わるATPaseで、 ATPase は、ATPを加水分解してADPとリン酸を生じる酵素の総称である。つまりAAAは、多様な細胞活性と関連するATPアーゼである。
ATPの加水分解は、19S複合体がタンパク質の立体構造をほぐすのを手助けし、20S触媒コアの高次構造変化を誘起し、その結果、タンパク質が複合体の中央に入り込めるようにしている。
タンパク質分解活性部位は、潜在的な基質から、複合体構造により隔離されており、それらが円筒中に入ってきて初めて接触する。βサブユニットには、3種類の異なった活性部位があり、それぞれが異なった特異性がある。しかし、これらのβ鎖は、すべてN末端にトレオニン残基を持つ。トレオニン残基のヒドロキシ基は求核試薬となり、ペプチド結合のカルボニル基を次に攻撃し、アシル酵素中間体を作る。基質は、分解された中間体を放出することなく、段階を経て7~9残基の長さを持つペプチドにまで分解される。これらのペプチド生成物は、プロテアソームから放出され、他の細胞内のプロテアソームによってさらに分解され個々のアミノ酸になる。従ってユビキチン径路とプロテアソームは、協同的に不必要なタンパク質を分解する。
ユビキチ化したタンパク質は、プロテアソームと他のタンパク質分解酵素によって、遊離アミノ酸が生成される。まずは、ペプチドフラグメントpeptide fragmentへと分解され、ついでユビキチンは切り離されて再利用される。ペプチドフラグメントは、さらに分解され遊離アミノ酸になり、それぞれは種々の生合成に再利用される。特に顕著なのがタンパク質への再合成である。
脂肪酸やグルコースとは異なり、生合成に必要な量を上回った過剰なアミノ酸は、体内に保存はできないが、排出もされない。余剰なアミノ酸は代謝の燃料として使われる。また、α-アミノ酸が脱離して、残った炭素骨格(ある化合物において、炭素同士が結合している部分)が主要代謝中間体へ変換される。余剰アミノ酸は、殆どが尿素回路で尿素に変換される。生体にとって有毒なアンモニアを、尿素に変えて無毒化する経路が尿素回路である。各組織で生成したアンモニアの窒素は、アミノ酸の1つであるグルタミンまたはアラニンとして血流で肝臓に運ばれる。肝臓において、アンモニアはその尿素回路で尿素に変えられる。
炭素は中程度の電気陰性度(電子と原子の間の親和性を示す尺度)を持つため、C-C結合を繰り返す炭素鎖が作れ、さらに、その炭素同士は強い共有結合をするため安定する。そのおかげで、炭素原子は「炭素骨格」とよばれる鎖状構造が作れる。これによりタンパク質などの有機物の大分子を形成し、細胞内で独特で多様な役割を果たすことになる。同じく有機物を構成するN原子やO原子では、電気陰性度が大きいため、安定した長い窒素鎖や酸素鎖を形成できない。やがて、炭素骨格は、アセチルCoA・アセトアセチルCoA・ピルビン酸などのクエン酸回路の中間体の1つに変換されるばかりか、グルコース・グリコーゲン・脂肪などに再利用される。
ケラチン
細胞質ゾルcytosol(サイトゾル;細胞内部の呼称で、細胞質から細胞内小器官を除いた部分のこと)内には、大小様々な分子や細胞小器官が乱雑に入り混じっているわけではない。真核細胞の細胞質ゾル内には、細い線維が縦横に走っている。この線維の一端が膜に付着するか、核の直ぐ側の細胞中心から放射線状に伸びたりしている。このタンパク線維系を細胞骨格cytoskeletonと呼ぶ。
 細胞骨格とも言うタンパク質も、数多くのタンパク質からなる一定の集合体から作られる。細胞骨格は、細胞質の中に張り巡らされた骨組みのようなもので、細胞の形態維持や細胞の運動に関わり、細胞小器官organelleの位置を決める。アクチン繊維・微小管(細胞分裂の際に形成される分裂装置の主体)・中間径繊維intermediate filament(ミオシンフィラメントとアクチンフィラメントの中間の径10nmであることから中間径フィラメントと呼ばれる)などが細胞骨格にあたる。それらのタンパク質は、何百、何千という単位で集合して、一定の方法で重合し繊維状の構造体を作る。
細胞骨格とも言うタンパク質も、数多くのタンパク質からなる一定の集合体から作られる。細胞骨格は、細胞質の中に張り巡らされた骨組みのようなもので、細胞の形態維持や細胞の運動に関わり、細胞小器官organelleの位置を決める。アクチン繊維・微小管(細胞分裂の際に形成される分裂装置の主体)・中間径繊維intermediate filament(ミオシンフィラメントとアクチンフィラメントの中間の径10nmであることから中間径フィラメントと呼ばれる)などが細胞骨格にあたる。それらのタンパク質は、何百、何千という単位で集合して、一定の方法で重合し繊維状の構造体を作る。皮膚や骨などの結合組織にあるコラーゲンと言うタンパク質は、何千、何万個もの分子が集合して、アキレス腱のような丈夫な繊維を作る。
タンパク質は、同じ種類、あるいは違ったもの同士で、一時的な集合体を作ったり、あるいは長期間の会合をしたりして、機能を発揮する性質を持つ高分子である。集合する際には、タンパク質自身が集合して自動的に複合体を作ることもあるが、介添え役のタンパク質が働くこともある。
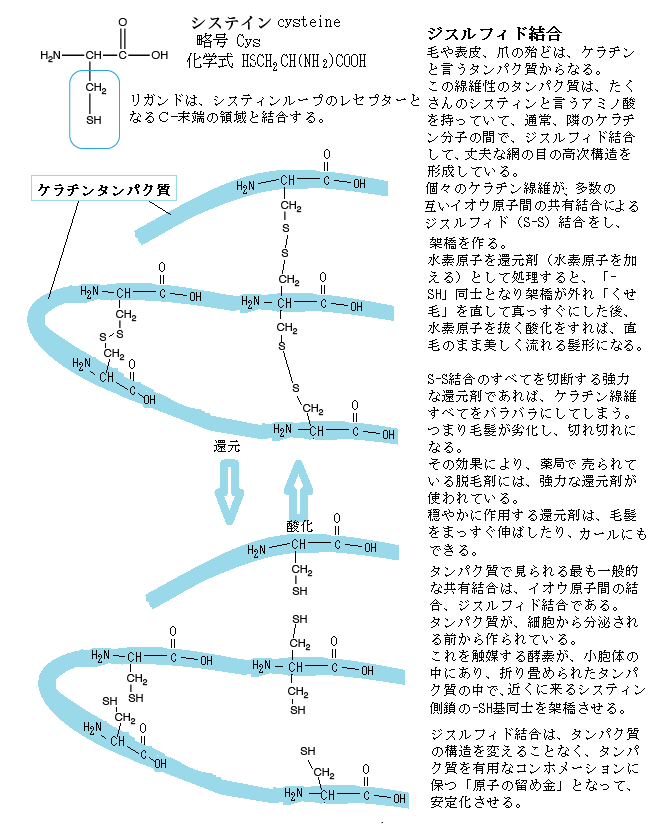
表皮や毛、爪には「ケラチン」と言う呼ぶ線維性のタンパク質がたくさん集まっている。特に、髪の毛の約8割は「ケラチン」というタンパク質で作られている。ケラチンは18種類のアミノ酸の結合によってできており、構成されるアミノ酸の割合で、毛髪は硬ケラチン、皮膚の角質層は軟ケラチンに分けられる。ケラチンは多くのアミノ酸の集合体であるが、アミノ酸同士の結合の仕方がいくつかある。
ケラチンタンパク質は、ポリペプチドを主鎖としたαヘリックス(ラセン状)の構造をしている。ポリペプチド主鎖は、隣り合った主鎖同士が横に繋がる「側鎖結合」しており、この横の繋がりがケラチン分子を固定し、強度や弾力などいろいろな特性をケラチンに与えている。主な側鎖結合として、イオウ同士の結合である「シスチン結合cystine bond(ジスルフィド結合Cystine is the oxidized dimer form of the amino acid cysteine.)」が、髪の「ケラチンタンパク質」の特性を形成する。それに最も多く含まれるのが、イオウ成分を含むアミノ酸、それが「シスチン」である。システィンは非必須アミノ酸で、アジ・サバ・イワシ・サンマなどの青魚や白身魚、ササミ・チーズ・大豆製品など、幅広い食生活により自然に体内で合成される。
システインは 、通常、タ ンパ ク 質の中には 1% 程 度 しか含まれていないが、髪の毛や爪などを作っているケラチンには14~18% ものシステインが含まれている。システイン の 側 鎖の -SH 基 ( チ オ ール 基 ;ス ル フ ヒ ドリル 基 )は 容 易 に酸化 され、ジ ス ル フ ィ ド結 合 が 形成 さ れ る 。そ の た め 、タ ン パ ク質問 の あ ち こ ち で架橋が渡されて、他の タ ン パ ク質 よりも硬く強 くなっ て い る 。 髪 の 毛や 爪 が 燃 えた と きの 不 快 な に お い は、ケラチンの イオウ が 燃 え て で きた 酸化物 の に お い で あ る 。
タンパク質の中には、細胞膜の外側に付着したり、分泌される細胞外マトリックスの一部となったりするのも少なくない。そうしたタンパク分子は、いずれも、細胞外の環境にさらされるので、そのポリペプチド鎖間に共有結合の架橋を作り、その三次元構造の安定を保とうとする。それに関わる巨大分子を構成する特定の炭素原子が介して、弾性線維のような大きなタンパク質複合体の相互関係を構成する。それにより、複雑にして精密な作用を繰り返す重層的な四次元構造が実現される。
タンパク質間で見られる一般的な共有結合による架橋は、イオウ原子間の結合、ジスルフィド結合であり、一対のシステイン残基の酸化により形成される。その結果生じた結合システインの単位をシスチンcystineと言う。これを触媒するのが、小胞体の中にある酵素で、折り畳められたタンパク質の中で、近くに寄るタンパク質のシスティン側鎖の-SH基同士が連結する。小胞体に入ったタンパク質の多くは、化学的に修飾される。ジスルフィド連結は、小胞体内腔の酵素により、1対のシスティンタンパク質の三次元構造を変えることなく、タンパク質をより動的に有効活用するためのコンホメーションを築く「原子の留め金」としての役割を果たし安定化する。
数多く、イオウを含むアミノ酸のシステインcysteineが、会合するペプチド鎖に取り込まれ、個々のペプチドとの間で共有結合が形成される。システインは、分子内に -SH をもち、容易に酸化されて2分子が結合し「シスチン」になる。その-SH基同士がジスルフィド結合disulfide bond(-S-S結合)を作り、タンパク質が四次構造となり、全体として網目構造となる。ジスルフィド結合の全体的な構造はR-S-S-R'となる。
水素原子が加わる還元が起きると、-SHとHS-同士になるため、ジスルフィド結合の-S-S同士の架橋が外れ、毛であれば髪をとけば、隣同士のケラチンタンパク質との間にずれが生じる。その後、水素原子を抜く酸化が生じると、-S-S結合が再生される。これがパーマの原理となる。一つの-S-Sに頼る共有結合それぞれを切断するのに必要なエネルギーは、他の一群の非共有結合が、すべてを切断する際のエネルギーよりもはるかに超えている。つまり、ジスルフィド結合が、タンパク質の折り畳み構造の安定化を主導していると言える。
目次へ
パーマ剤1剤には還元剤が配合され、毛髪を軟化させ膨潤にさせる。2剤には酸化剤が配合され、ウェーブを固定する。また、1剤と2剤の間には、必ず中間水洗を行う必要がある。
パーマ剤1剤の有効成分であるチオグリコール酸やシステインは、還元剤の水素原子を与えることで、毛髪中のシスチン結合を切断できる。このパーマ剤1剤の大半は、アルカリ剤が配合されている。このアルカリ剤が毛髪を膨潤させ、還元剤を浸透し易くしている。そのアルカリ剤は、毛髪内部のイオン結合を切断する作用が働く。
側鎖結合として、カルボキシ基の酸素イオンとアミノ基の水素イオン同士がイオン結合により隣り合ったペプチド主鎖同士が電荷的にも結合するのだが、pH4.5~pH5.5の酸性状態で、結合力は最大となり、ケラチンは最も安定するので毛髪は丈夫になる。イオン結合は、ジスルフィド結合より弱いが、水素結合より強い。
水素結合は、髪を濡らすと簡単に切れる。乾かすとまた繋がる。ヘアカットの際、髪を濡らすと水素結合が切れるので髪は柔らかくなる。
1剤の働きで毛髪は側鎖の結合が切断され、1剤で切断されたシスチン結合は、毛髪がロッドに巻かれたり、伸ばされたりすることによって、毛髪の形状に変化が生じる。2剤の有効成分である臭素酸塩や過酸化水素は、酸素を放出することによって、水素原子を奪い、切断したシスチンをジスルフィド結合の-S-S同士の架橋を復活させる。この水素を奪う反応を「酸化」といい、酸化を行う成分である臭素酸塩や過酸化水素を「酸化剤」と呼ぶ。この2剤の酸化の働きは、臭素酸塩は酸性で強まり、過酸化水素はアルカリ性で強まりまる。
パーマは1剤で毛髪内のシスチン結合を還元して切断し、2剤で酸化して再結合させることで架橋され、ウェーブパーマとストレートパーマの違いは、1剤でシスチン結合を切断した後、2剤で酸化するときに毛髪が曲がっているか真っ直ぐかの違いだけで、かかる仕組みは同じである。
毛髪は、キューティクル(毛表皮)とCMC(細胞膜複合体)を含むキューティクル領域、コルテックス(毛皮質)とCMCを含むコルテックス領域、メデュラ(毛髄質)と呼ばれる3層からなる。毛髪の中心部にあるメデュラは、細い毛にはなく普通毛でも途中で途切れている場合もある。毛髪の弾力(コシ)や透明感、動きのあるツヤは、メデュラを含む毛髪全体で決定される。
3層構造になっている毛髪の中間層部分は、毛皮質cortexとも呼ばれる。このコルテックス領域が毛髪全体の85~90%を占め、水分を保持し毛髪の強度や、コルテックス内にあるメラニン色素により髪色を決定している。
コルテックスは、毛髪の縦方向に沿った細長い微細繊維状のタンパク質が集まり、束状になっている硬い部分(結晶領域)とそれを取り巻くように存在する非定型の柔らかい部分(非結晶領域または間充物質)に分かれている。どちらにもシスチン結合や自己の価電子を結合する他の原子に移動させることにより生じるイオン結合と、結合する原子相互の電気陰性度の差によって生じる水素結合が存在している。
硬い結晶領域は、強い力で処理しない限り反応しないので、パーマ剤に殆ど影響されない。その半面、非結晶領域は、CM C (細胞膜複合体)と呼ばれる親水性領域で、結晶領域にある長く縦に繋がるコルテックス細胞同士や、コルテックス領域の外周となるキューティクル同士を接着し、水分を保ち髪の栄養分の流出も防いでいる。CMCは、タンパク質の層が油の層に挟まる三層構造で、毛髪内のタンパク質の流失を防ぎ、水の出入りをコントロールする。また、反応しやすい部分となり、ヘアカラーやパーマなどの薬剤の通り道となって、毛髪内部に浸透する際、必要以上に入り過ぎないよう浸透調整をする。毛髪内部の水分量を一定に保つことで、毛髪内部から潤いを与える。
キューティクルは無色透明なウロコ状で、1枚で毛髪の外周の1/2~1/3を包み、檜皮葺や瓦屋根のように重なっている。キューティクル領域にあるCMCはキューティクルとキューティクルの間にあって、キューティクル同士を接着し、外部からの物理的・化学的刺激からキューティクルを守って毛髪成分の流出を防ぐ。その一方で、アミノ酸などの保湿成分や親水性タンパク質などから作られているので、水や薬剤の通り道となっている。キューティクル領域で毛髪全体の10~15%を占め、毛髪のツヤや手触り硬さを決定しており、またブラッシングによる物理的刺激、及び水や薬剤といった化学的刺激から毛髪内部を保護している。
ロッドなどで巻かれた毛髪は、非結晶領域の内部に歪ができ、ここにパーマの1剤を作用させると、非結晶領域内のシスチン結合が切断されて軟化する。この状態で2剤を作用させると、非結晶領域の構造が変化した状態で、シスチン結合が再結合され硬化する。
極度に傷んだ毛髪にパーマがかからないのは、毛髪の非結晶領域が流出しているため、パーマ剤の作用する部分が少ないためである。
ヘアサイクルが正常な状態であれば、通常、長くて硬い髪の毛は、1日に50~100本程度抜けるのが普通である。そのヘアサイクルが乱れると、抜け毛やフケ、薄毛などを引き起こす。成長期が短くなってしまうことにより、髪の毛がしっかり太い毛に成長することができずに、成長途中の柔らかくて短い髪にしかなれず、抜け毛の本数も多くなってくる。
目次へ