| Top 車山高原 車山高原お知らせ 車山ブログ 歴史散歩
|
 |
DNA DNAが遺伝物質 生物進化と光合成 葉緑素とATP 植物の葉の機能 植物の色素 葉緑体と光合成
花粉の形成と受精
ブドウ糖とデンプン 植物の運動力 光合成と光阻害 チラコイド反応 植物のエネルギー生産 ストロマ反応
植物の窒素化合物 屈性と傾性(偏差成長) タンパク質 遺伝子が作るタンパク質 遺伝子の発現(1)
遺伝子の発現(2) 遺伝子発現の仕組み リボソーム コルチゾール 生物個体の発生 染色体と遺伝
減数分裂と受精 対立遺伝子と点変異 疾患とSNP 癌変異の集積 癌細胞の転移 大腸癌 細胞の生命化学
イオン結合 酸と塩基 細胞内の炭素化合物 細胞の中の単量体 糖(sugar) 糖の機能 脂肪酸
生物エネルギー 細胞内の巨大分子 化学結合エネルギー 植物の生活環 シグナル伝達 キク科植物
陸上植物の誕生 植物の進化史 植物の水収支 拡散と浸透 細胞壁と膜の特性 種子植物 馴化と適応
根による水吸収 稲・生命体 胞子体の発生 花粉の形成 雌ずい群 花粉管の先端成長 自殖と他殖
フキノトウ アポミクシス 生物間相互作用 バラ科 ナシ属 蜜蜂 ブドウ科 イネ科植物 細胞化学
ファンデルワールス引力 タンパク質の機能 呼吸鎖
| 目次 |
| 1)DNAとRNAの違い |
| 2)ギブズ自由エネルギーGibbs free energy |
| 3)リン酸化 |
| 4)細胞のエネルギー利用 |
 DNAとRNAはヌクレオチドnucleotideと呼ばれる構成単位からなる。語源はnucleo(核の)、tide(結ばれた)と言う意味である。英語では「núkliətàɪd」と発音する。
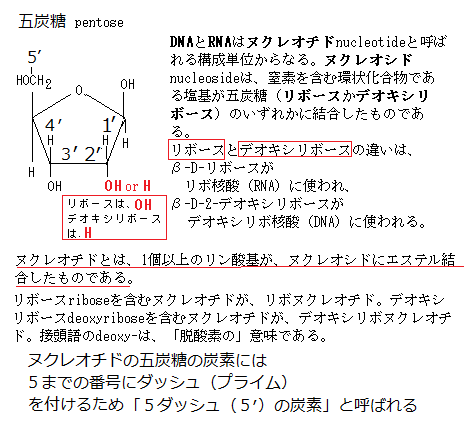
DNAとRNAはヌクレオチドnucleotideと呼ばれる構成単位からなる。語源はnucleo(核の)、tide(結ばれた)と言う意味である。英語では「núkliətàɪd」と発音する。ヌクレオシドnucleoside(njúklisàid/)は、窒素を含む環状化合物である塩基が五炭糖(リボースかデオキシリボース)のいずれかに結合したものである。
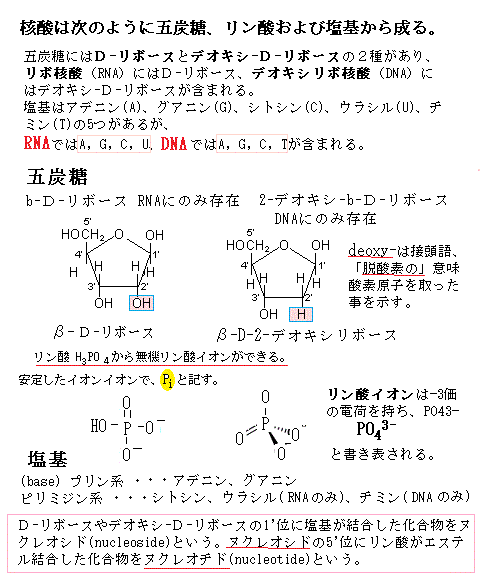
ヌクレオチドは、ヌクレオシドの五炭糖に1個以上のリン酸基が結合してでき、大きくは2種類に分けられる。リボースriboseを含むヌクレオチドは、リボヌクレオチド、デオキシリボースdeoxyriboseを含むヌクレオチドは、デオキシリボヌクレオチドと言う。接頭語のdeoxy-は、「脱酸素の」意味である。リボース(五炭糖)の2´炭素原子に結合している酸素原子が、デオキシリボースでは失われていることを示す。糖の炭素原子は、塩基の原子と区別するために2´のようにダッシュ´の付いた数字で表すことになっている。
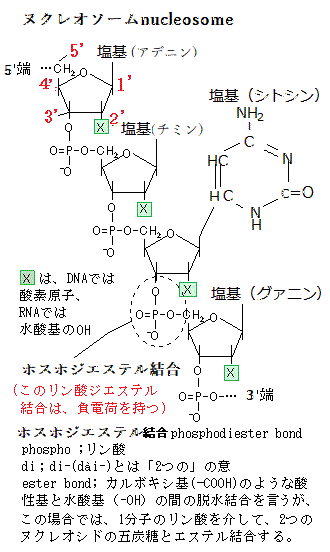
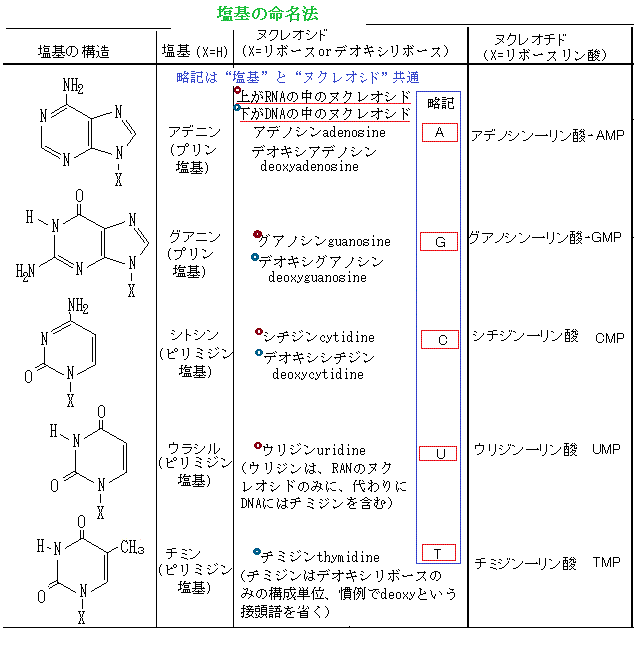
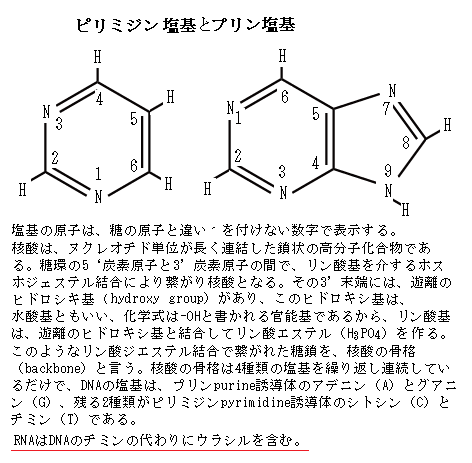
 ヌクレオチドを形成する窒素分子を含む環を塩基と呼ぶ。酸性条件下でH+(プロトン)と結合して、水溶液中のOH-濃度を高めるからである。塩基は大きく分けて2種類あり、六員環化合物ピリミジンの誘導体であるシトシン(C)・チミン(T)・ウラシル(U)をピリミジン塩基、五員環と六員環が縮合した化合物プリンの誘導体であるグアニンとアデニンをプリン塩基と呼ぶ。 RNAのリボ核酸ribonucleic acidもDNAと同様、ヌクレオチドに含まれる3´-ヒドロキシ基(3´-OH基)と5´-ヒドロキシ基を結ぶリン酸ジエステル結合が作られている。これにより繋がれた糖鎖を核酸の骨格backboneと言う。
ヌクレオチドを形成する窒素分子を含む環を塩基と呼ぶ。酸性条件下でH+(プロトン)と結合して、水溶液中のOH-濃度を高めるからである。塩基は大きく分けて2種類あり、六員環化合物ピリミジンの誘導体であるシトシン(C)・チミン(T)・ウラシル(U)をピリミジン塩基、五員環と六員環が縮合した化合物プリンの誘導体であるグアニンとアデニンをプリン塩基と呼ぶ。 RNAのリボ核酸ribonucleic acidもDNAと同様、ヌクレオチドに含まれる3´-ヒドロキシ基(3´-OH基)と5´-ヒドロキシ基を結ぶリン酸ジエステル結合が作られている。これにより繋がれた糖鎖を核酸の骨格backboneと言う。核酸の骨格は4種類の塩基が繰り返し連続しているだけの分岐ない長い重合体である。
RNAとDNAの共有結合は、構造式においても極めて共通点が多いが、重要な違いが2つある。
1つは、RNAの五炭糖は、デオキシリボースdeoxyriboseでなく、2´の位置にヒドロキシ基hydroxy groupのあるリボースであること。「deoxy」は「脱酸素の」を意味する接頭語である。デオキシリボースの2´の位置には、酸素原子が含まれていない。
2つは、RNAの4種類の塩基の1つが、DNAのチミン(T)でなくウラシル(U)である。
1つ目が特に重要で、リン酸ジエステル結合が負電荷を帯びていることにより、水酸化物イオン(OH-で表される陰イオン)のような、リン酸骨格を加水分解する作用を持つ求核性の化学種の原子が近づけなくなる。この加水分解を受けなくなる抵抗性は、核酸に保持された遺伝情報が確実に持続するためには極めて重要である。またDNAには2´-ヒドロキシ基(-OH-)がない、酸素原子が「deoxy」され水素原子Hだけであるため、より加水分解が受けにくくなる
このことがあらゆる生物細胞や、生物体に猛威を振るうウイルスにおいても、不安定なRNAではなく、DNAが遺伝物質として使われ出した大きな理由であろう。
核酸(DNAとRNA)を構成する単量体はヌクレオチドである
 核酸の構成単位やその前駆体は、遺伝情報以外にもエネルギーの運搬体としてシグナル分子などとして細胞内で多くの役割を果たしている。糖1分子に塩基1分子が結合した単位をヌクレオシドnucleosideと言う。RNAの中の4種類のヌクレオシドは、アデノシンadenosine、グアノシンguanosine、シチジンcytidine、ウリジンuridine、DNAの中のヌクレオシドには、デオキシアデノシンdeoxyadenosine、デオキシグアノシンdeoxyguanosine、デオキシシチジンdeoxycytidine、チミジンthymidine(RNAにはチミジンを含むヌクレオシドが殆ど存在しないので、チミジンはデオキシリボースの構成単位であるが、慣例でdeoxyという接頭語を省く)と呼ばれる。いずれもプリンのN-9、あるいはピリミジンのN-1が、糖のC-1´とN-グリコシド結合している。その構造を標準的な配置で描き表すと、塩基が窒素を含む環状化合物である五炭糖pentose(リボースかデオキシリボースのいずれか)が作る平面の上に位置する。このN-グリコシド結合は、β-グリコシド結合の立体配置をとっていることになる。
核酸の構成単位やその前駆体は、遺伝情報以外にもエネルギーの運搬体としてシグナル分子などとして細胞内で多くの役割を果たしている。糖1分子に塩基1分子が結合した単位をヌクレオシドnucleosideと言う。RNAの中の4種類のヌクレオシドは、アデノシンadenosine、グアノシンguanosine、シチジンcytidine、ウリジンuridine、DNAの中のヌクレオシドには、デオキシアデノシンdeoxyadenosine、デオキシグアノシンdeoxyguanosine、デオキシシチジンdeoxycytidine、チミジンthymidine(RNAにはチミジンを含むヌクレオシドが殆ど存在しないので、チミジンはデオキシリボースの構成単位であるが、慣例でdeoxyという接頭語を省く)と呼ばれる。いずれもプリンのN-9、あるいはピリミジンのN-1が、糖のC-1´とN-グリコシド結合している。その構造を標準的な配置で描き表すと、塩基が窒素を含む環状化合物である五炭糖pentose(リボースかデオキシリボースのいずれか)が作る平面の上に位置する。このN-グリコシド結合は、β-グリコシド結合の立体配置をとっていることになる。ヌクレオチドとは、1個以上のリン酸基が、ヌクレオシドにエステル結合したものである。ヌクレオシド三リン酸、即ちヌクレオシドに3個のリン酸基が結合した単量体が、RNAやDNAの合成において構成単位として利用されるため、大きく2種類に分類される。DNAを構成するヌクレオチドは、デオキシアデニル酸deoxyadenylate、デオキシグアニル酸deoxyguanylate、デオキシシチジル酸deoxycytidylate、チミジル酸thymidylateという4種類のヌクレオシドーリン酸である。同様に、RNAを構成する最も一般的なヌクレオチドは、ヌクレオシドーリン酸であるアデニル酸、グアニル酸、シチジル酸、ウルジル酸である。つまり、各ヌクレオチドの名前は、結合する塩基の名前に由来する。
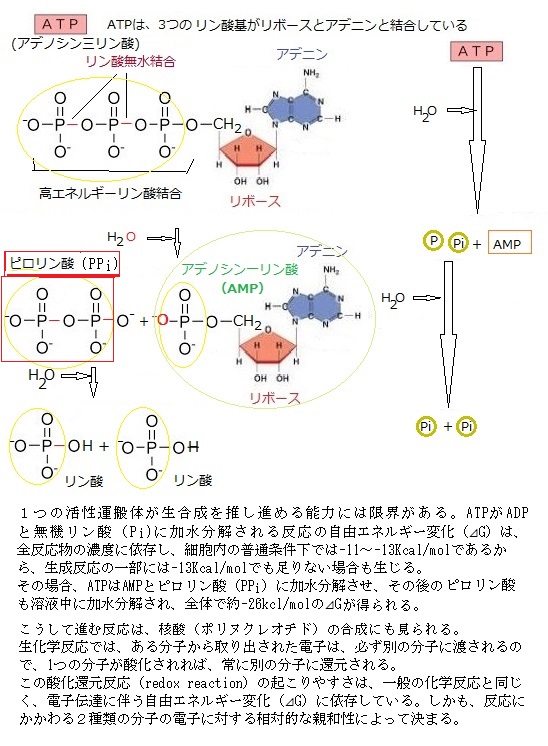
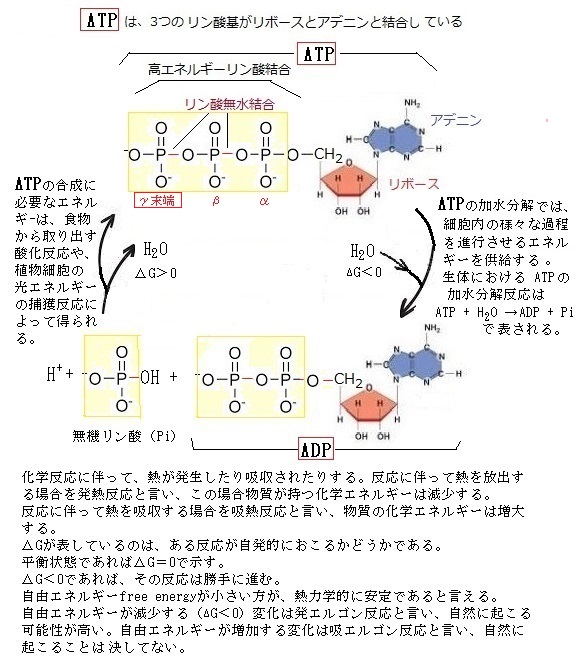 ヌクレオチドには、エネルギーを短期間保有する能力がある。中でもアデノシン三リン酸adenosine triphosphate(ATP)は、数百もの代謝反応に際してエネルギーの受け渡しに関与している。ATPは、植物細胞や一部の細菌などのように、光エネルギーの捕獲反応によって得られるか、動物細胞・菌類・一部の細菌などのように、食物の酸化的分解で放出されるエネルギーによって合成され、結合している3個のリン酸基は、リン酸無水結合により形成されている。これらの結合が切れる際に生じる多量のエネルギーが生合成反応を進行させる。特に、先端のリン酸基は、加水分解により容易に切られ、他の分子へ移ると同時にエネルギーが発生する。ATPの加水分解では、細胞内の様々な過程を進めるエネルギーを供給するが、これらの反応によりATPが循環される。例えば、ATPはADPと無機リン酸の結合により合成されるが、そのATPは容易に加水分解によりADPと無機リン酸に戻る。その際にエネルギーが放出される。実際、他のヌクレオチド誘導体も、様々な基を運ぶ働きをする。
ヌクレオチドには、エネルギーを短期間保有する能力がある。中でもアデノシン三リン酸adenosine triphosphate(ATP)は、数百もの代謝反応に際してエネルギーの受け渡しに関与している。ATPは、植物細胞や一部の細菌などのように、光エネルギーの捕獲反応によって得られるか、動物細胞・菌類・一部の細菌などのように、食物の酸化的分解で放出されるエネルギーによって合成され、結合している3個のリン酸基は、リン酸無水結合により形成されている。これらの結合が切れる際に生じる多量のエネルギーが生合成反応を進行させる。特に、先端のリン酸基は、加水分解により容易に切られ、他の分子へ移ると同時にエネルギーが発生する。ATPの加水分解では、細胞内の様々な過程を進めるエネルギーを供給するが、これらの反応によりATPが循環される。例えば、ATPはADPと無機リン酸の結合により合成されるが、そのATPは容易に加水分解によりADPと無機リン酸に戻る。その際にエネルギーが放出される。実際、他のヌクレオチド誘導体も、様々な基を運ぶ働きをする。目次へ
 化学反応に伴って、熱が発生したり吸収されたりする。反応に伴って熱を放出する場合を発熱反応と言い、この場合、物質が持つ化学エネルギーは減少する。
化学反応に伴って、熱が発生したり吸収されたりする。反応に伴って熱を放出する場合を発熱反応と言い、この場合、物質が持つ化学エネルギーは減少する。
反応に伴って熱を吸収する場合を吸熱反応と言い、物質の化学エネルギーは増大する。
発エルゴン反応exergonic reaction・吸エルゴン反応endergonic reactionという呼び方は、放出されるエネルギーが熱だけではない 、化学エネルギーの場合が多いため、ギブズ自由エネルギーGibbs free energyという上位の概念を導入する必要が出てくる。物理学のエネルギーや「仕事」の単位である「エルグerg」の語源でもあるergonは、ギリシャ語εργονでは「仕事」を意味する。ギブズ自由エネルギーGibbs free energyを、単にGibbs energy と呼ぶこともある。通常は G で表される。
以下の発エルゴン反応・吸エルゴン反応に関しては、発熱・吸熱反応と対応させながら考えたい。
したがって、ギブズ自由エネルギーが小さい方が、熱力学的に安定であると言える。
ΔGが表しているのは、ある反応が自発的におこるかどうかである。
平衡状態であればΔG=0で示す。
ΔG<0であれば、その反応は勝手に進む。
自由エネルギーが減少する(∆G<0)変化は発エルゴン反応と言い、自然に起こる可能性が高い。可逆反応などで反応が進むとき、自由エネルギーが極小値(∆G = 0)になると変化(反応)の進行は止まる。これを化学平衡と言う。
自由エネルギーが増加する変化は、吸エルゴン反応と言い、自発的には起こらず、外部からのエネルギーが必要になる。この化学反応前後で自由エネルギー差が正になる、つまり外部からエネルギーを吸収する反応であることを意味する。これは、発エルゴン反応で発生したエネルギーを用いることで、非自発反応である吸エルゴン反応を起こすことができるからである。生体内では、より大きな負の自由エネルギー変化を伴う発エルゴン反応とカップルさせることで、吸エルゴン反応を進行させている。これを「反応の共役」という。
自由エネルギー変化(∆G<0) の大きさはその変化によって外部に取り出せる最大の仕事(W>0)の大きさである。
生体における ATP の加水分解反応は
ATP + H2O →ADP + Pi と表記される。
ヌクレオチドは、生物にとって必要な、情報の貯蔵と取出しと言う根本的な役割を担う。ヌクレオチドは核酸の構成単位であり、2つの糖のヒドロキシ基とリン酸基の間で共有結合するホスホジエステル結合により次々と繋がり長い重合体を作る。2つのヌクレオシドが、1つ無機リン酸イオンを介して、それぞれの五炭糖の5´と3´との間でエステル結合してヌクレオチドを形成しDNAやRNAの長い鎖の単量体となる。
目次へ
 リン酸phosphoric acidは、生体物質を構成する最も重要な無機酸であり、ATPはもとよりヌクレオチドや核酸、生体膜を形成するリン脂質phospholipidは、すべてリン酸のエステルである(lipid;脂質)。真核細胞内のあらゆる代謝過程の調節機構で、リン酸化が見られるのは、その細胞内のタンパク質の30%近くがリン酸化されているからである。リン酸化反応を触媒する酵素は、プロテインキナーゼprotein
kinaseと呼ばれる、最も巨大なタンパク質ファミリーの1つでもある。ヒトでは500以上の相同な酵素を持つ。その酵素の多様性により、特定の組織・時間・基質などの諸条件が絡む微妙な調節を可能にしている。
リン酸phosphoric acidは、生体物質を構成する最も重要な無機酸であり、ATPはもとよりヌクレオチドや核酸、生体膜を形成するリン脂質phospholipidは、すべてリン酸のエステルである(lipid;脂質)。真核細胞内のあらゆる代謝過程の調節機構で、リン酸化が見られるのは、その細胞内のタンパク質の30%近くがリン酸化されているからである。リン酸化反応を触媒する酵素は、プロテインキナーゼprotein
kinaseと呼ばれる、最も巨大なタンパク質ファミリーの1つでもある。ヒトでは500以上の相同な酵素を持つ。その酵素の多様性により、特定の組織・時間・基質などの諸条件が絡む微妙な調節を可能にしている。プロテインキナーゼの特性が活用される範囲は様々で、専用プロテインキナーゼは、1つのタンパク質ばかりか、それに密接に関連するいくつかのタンパク質をリン酸化する。
多機能プロテインキナーゼは、多くの異なる標的タンパク質を修飾する。この種のキナーゼは広範囲に作用し多様な過程を調節する。それでも、多くのリン酸化部位のアミノ酸配列を比較すれば、多機能性キナーゼが、関連性のある様々な共通する配列を認識していることが見えてくる。
例えば、プロテインキナーゼAが、認識するアミノ酸に、Arg-Arg-X-Ser-Zか、Arg-Arg-X-Thr-Zの共通配列consensus sequenceがある。Xは小さな残基、Zは大きな疎水性残基、Argはアルギニンであるが、この配列は絶対的なものではなく、例えば親和性を多少失うがアルギニン残基の1つをリシンに置き換えることもできる。この特異性を決定する第一の要因は、リン酸化部位のセリン(Ser)とトレオリン(Thr)を取り巻くアミノ酸配列と言える。また離れている残基が、特異性に関与することもあり、例えば、タンパク質の高次構造の変化が、リン酸化される可能性の部位へ導く場合もある。
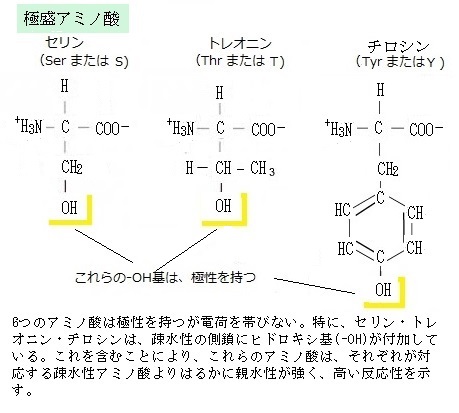
 ATPは代表的なリン酸供与体で、ATPのγ末端のリン酸基は、反応を触媒する酵素により、受容体タンパク質や酵素の特異的なアミノ酸に転移される。その真核細胞の受容体の残基は、側鎖にヒドロキシ基を持つ3つのアミノ酸の1つであることが通例である。
ATPは代表的なリン酸供与体で、ATPのγ末端のリン酸基は、反応を触媒する酵素により、受容体タンパク質や酵素の特異的なアミノ酸に転移される。その真核細胞の受容体の残基は、側鎖にヒドロキシ基を持つ3つのアミノ酸の1つであることが通例である。ある一群のプロテインキナーゼによって特定のセリンやトレオニン残基に、また別の一群のプロテインキナーゼによってチロシン残基に転移が起きる。特に、チロシンキナーゼは、多細胞生物に特有で、成長を制御する中心的な役割を果たしているが、この酵素の変異が癌細胞の多くで確認されている。タンパク質リン酸化反応の受容体タンパク質は、リン酸供与体であるATPが豊富にある細胞内に見られるが、完全に細胞外にあるタンパク質では、リン酸化と脱リン酸化による活性化と非活性化の循環を、機能的に調節することはない。
ホスホプロテインホスファターゼphosphoprotein phosphataseは、タンパク質に結合したリン酸基を加水分解的に除去し、プロテインキナーゼとは逆効果を持つ反応を触媒する。-アーゼ(-ase)は、生化学において、酵素の命名に用いられる接尾辞である。ギリシア語のδιαστασις(分離)と言うアスターゼに由来している。
ホスファターゼphosphataseは、リン酸エステルphosphate esterを加水分解する酵素の総称である。水酸基とリン酸基との間の結合を、加水分解する脱リン酸化の過程を触媒する酵素のことで、それにより修飾の無いヒドロキシ基を持った側鎖が再生され、同時にオルトリン酸(Pi)が生じる。このファミリーの酵素は、ヒトでは約200種類存在し、キナーゼのよって活性化されたシグナル伝達経路を止めるので細胞内では極めて重要な役割を果たす。
PP2Aと呼ばれる一群の高度に保存されたホスファターゼは、ある種のキナーゼの発がん性の活性化と、可逆的にその促進を抑制する。
このようにして、リン酸化と脱リン酸化による活性化と不活性を利用することで、細胞内分子の機能を制御している事例は多く、例えば、インスリンのシグナル伝達系でも反応径路が用意されており、リン酸化と脱リン酸化の両者を拮抗させることによって、良好なのシグナルが伝達されるように調整されている。
ホスファターゼは様々な生体分子の作用を伝達する際に、その機能のオン・オフを制御することによって伝えられる情報量を調整する役割を果たしている。これらの制御によって生体の恒常性が保たれるため、キナーゼとホスファターゼの作用は生体の維持に不可欠な存在であれば、その理解が深まる程に分子生物学の面白みが増す。
ただリン酸化と脱リン酸化は可逆反応ではなく、関連する生化学反応の本質的は、むしろ不可逆的である。その上、その両反応は酵素が介入しなければ無視されがちな速度でしか進まない。基質タンパク質のリン酸化は、特異的なプロテインキナーゼの作用に依存し、しかも脱水縮合であればATPの分解によるエネルギーの放出が必要である。脱リン酸化もホスファターゼに頼らなければ生じない。つまりリン酸化を受けるタンパク質は、非リン酸化型とリン酸化型の間の一方向をなぞりながら循環している。その循環速度は、プロテインキナーゼとホスファターゼの相互の活性力で決まる。
リン酸化は、主にアミノ酸のセリン・トレオニンやチロシン残基を介してタンパク質と共有結合するが、その修飾が非常に重要になるので、標的タンパク質の活性を調節するためには、極めて効果的な方法であるようだ。リン酸化は細胞周期・増殖・アポトーシス・シグナル伝達経路といった様々な細胞プロセスの調節や細胞全体のシグナル伝達において主要なメカニズムを形成している。特に細菌細胞では、それがより普遍的に行われている。
プロテオームproteomeとは、「生体内の細胞や組織において、遺伝情報に基づいて発現された、すべてのタンパク質の一式」を意味する。つまり、プロテオームとはタンパク質proteinとゲノムgenomeを組み合わせた造語である。ゲノムが一個の生物が持つ全ての遺伝情報を示すに対し、プロテオームは、細胞内で発現している、または発現する可能性をもつものも含む、全タンパク質のことを言う。
ゲノム解析で得られる情報は、特定のタンパク質を作る可能性をもった遺伝子情報の集積でもあるから、プロテオーム解析によって、実際に、その細胞内で働いているタンパク質に関する情報の蓄積により、生物のゲノム情報は、産業化レベルまで達し、急速に実用化を促進している。
ヒトのプロテオーム中のタンパク質の三分の一は、ある時点でリン酸化された基質であると推定されている。実際、プロテインキナーゼは、多くの生命現象に関わっていると同時に、その活性異常が疾患の原因となることからも有望な創薬のターゲットになっている。
目次へ
 生命を持たないものは、放置すれば無秩序な状態になる。家屋は崩壊し死体は腐朽する。
生命を持たないものは、放置すれば無秩序な状態になる。家屋は崩壊し死体は腐朽する。 生きている細胞は、ヒトや樹木などの大掛かりなものから、それを構成する分子の組織に至るまで、生体を維持するためには代謝が欠かせない。
生物のこの性質は、環境からエネルギー源を受取り化学結合エネルギーに変えると言う万全な分子機構に支えられている。生物の命はこうして秩序を維持し、生体の組織の構成材料を常に入れ替えることで、循環しても形が変わることもなく保たれている。生体の構成原子が10年ほどで入れ替わったにしても、その基本構造は維持されている。
生体内の秩序の維持には、細胞からの熱エネルギーの放出が必要である。万物が必ず無秩序な状態に向かうことを、物理の基本法則である熱力学第2法則では、「宇宙、あるいは閉鎖系(外界から完全に孤立した物体の集合)では、乱雑さは増加する一方である」、と言う。確率という概念を使えば、第2法則は「系は放置すると最も確立の高い無秩序な状態に向かい、その動きは自発的で、それを逆行させるには度重なるエネルギーが必要である」と表現される。
系の乱雑さを測る量の系をエントロピーentropyと呼ぶ。乱雑なほどエントロピーは大きい。熱力学第2法則の3つ目の表現は、「系は放置されれば、エントロピーが増大する配置に向かう」となる。
生き続け、成長する複雑な組織の生命体と、そのものを形成する細胞は秩序を生み出すので、熱力学第2法則に反しているように見えるが、細胞は閉鎖系ではない。細胞は、食物や無機分子、太陽からの光子などからエネルギーを取り入れ、それを使い新たな化学結合を作り、巨大分子を構築して内部に秩序を生み出す。その化学反応の過程で、一部のエネルギーは熱として失われる。
熱は最も乱雑なかたちのエネルギーである。あらゆる物体は、分子あるいは原子でできているが、この分子、原子は常に乱雑に揺れ動いている。静止しているように見える場合でも微視的には揺れ動いている。この運動を熱運動と言う。細胞は閉鎖系ではないため、細胞 内の化学反応で生じた熱は直ちに周囲に散り、近くの分子の熱運動を激しくし、そのエントロピーを増加させる。
細胞が放出する熱の総量は、外界の乱雑さの増加の方が、細胞内の秩序の増加より多い分見合っている。熱力学第2法則は、細胞が成長し、大きな分子を構築することで、その要請を満たしている。
ギブズの自由エネルギーGibbs free energyをGとすると、
G=H-TS で示される。
Hはエンタルピーenthalpy、物体の持つエネルギーの総量で単位はkJで表され、また、単位質量当たりの物体の持つエネルギーは比エンタルピーと呼ばれkJ/kgで表される。熱力学では、温度のみで表されるエネルギーを内部エネルギーと呼び、圧力や体積などの仕事量も含んだエネルギーの総量をエンタルピーと呼んで使い分けている。熱力学では、エンタルピーや内部エネルギーは「状態量state quantity」として扱われる。
「状態量」、例えば圧力と体積、温度は「状態量」で、熱量は「状態量」ではない。熱力学の「状態量」として代表的なものには、温度[K]•圧力[Pa]•体積[m3]• エンタルピー[J]・エントロピー[J/K]がある。「状態量」は、系(巨視的な物質または場)の状態だけで一意的に決まり、過去の履歴や経路には依存しない物理量のことである。つまり、状態量は始まりと終わりの状態が同じだと変わらないもので、そのため、仕事[W=J/s]や熱[J]は状態量ではありえない。元来は熱力学的平衡状態にある系だけで定義されたものだが、非平衡状態にも拡張されて用いられるようになった。
Tは絶対温度、エンタルピーはHという記号を使って表されることが多い。
Sがエントロピーentropyで、物体の「乱雑さ」の指標となるような示量性、つまり系全体の量が、部分量の総和になるような性質を持っているという意味の状態量のことである。
例えば、飽和蒸気は圧力が大きくなれば、エンタルピーは小さくなっていく。これは、圧力が高くなると比体積が小さくなる分、存在できる範囲が狭まって「乱雑さ」が小さくなるからだ。
ΔSは、エントロピーの変化量
TSの部分を束縛エネルギーと呼ぶ。
自由エネルギー変化は
ΔG=ΔH-TΔSと表される。
ΔGが表しているのは、ある反応が自発的におこるかどうかで、
ΔG<0であれば
その反応は勝手に進み、
平衡状態であれば
ΔG=0
自由エネルギーが小さい方が、熱力学的に安定している。
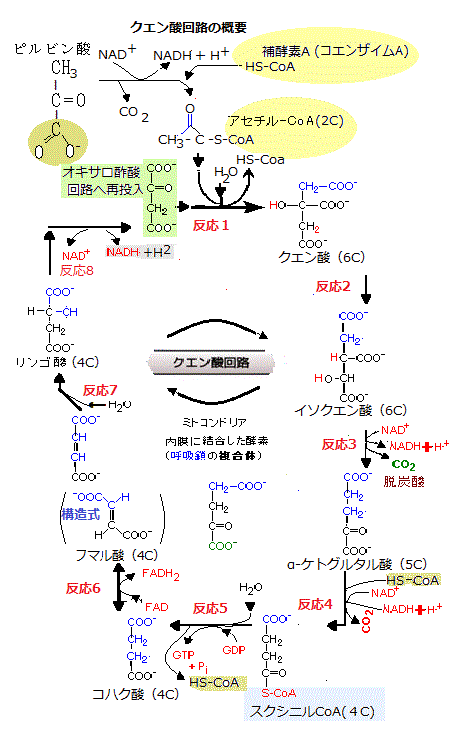
 リン酸化のギブズ自由エネルギーは大きい。すべての生物系における重要な活動は、エネルギーを一つの形から別の形に変換することにある。光合成では、光エネルギーが化学結合のエネルギーに変換される。
リン酸化のギブズ自由エネルギーは大きい。すべての生物系における重要な活動は、エネルギーを一つの形から別の形に変換することにある。光合成では、光エネルギーが化学結合のエネルギーに変換される。生物にとっての呼吸とは、何かものを酸化したときに得られるエネルギーを使って、ATPなどのエネルギーを運んでくれる分子を作ることで、その反応を総称する。
ミトコンドリアでは、取り込まれた有機物を無機物に分解し、その過程で出るエネルギーを利用してATPを合成する。息を吸って体に取り込んだ酸素は、その細胞内のミトコンドリアで有機物を分解する過程で使われ、その際にエネルギーが得られる。細胞の中で酸素を使い、酵素が有機物を分解し、そこからエネルギーを取り出す仕組みを呼吸respirationあるいは細胞呼吸cellular respirationと呼ぶ。
ミトコンドリアのクエン酸回路で起こる生化学反応の目的は、高エネルギー電子を生み出すことである。クエン酸回路で高い転移ポテンシャルの電子が生成され、電子伝達系を通して流れ、それに伴いATPが合成される酸化的リン酸化oxidative phosphorylationがミトコンドリアで起こることになる。
人間が生活してうえで必要とするATPは膨大である。殆ど体を動かさない70kgの男性でも、1日の活動では2,000Kcalを必要とする。この量に相当するエネルギーを用意するためには、83kgのATPが必要と言う。ところがヒトがいつも持つATPは250gだけである。その差を埋めるため、ADPをATPに、ATPからADPに循環させている。ATP1分子は、主に酸化的リン酸化によって、1日当たり約300回もリサイクルされている。
ミトコンドリアには、外膜outer membraneと内膜inner membraneの2枚の膜がある。外膜にはチャネルを形成するポーリンporinと呼ばれる大型の外膜タンパク質があり、糖・イオン・アミノ酸などを受動的拡散passive diffusionを許すほど大きな孔poreを持ち、かなり大きな分子もこのチャネルを通って、外膜を出入りしている。対照的に、内膜は透過性の悪い膜で、イオンを通さず、極めて選択性に富んでいる。内膜には呼吸鎖の酵素系や輸送タンパク質がびっしりと敷きつめられ、膜重量の70~80%を占めている。内膜で包まれたミトコンドリアの内部をマトリックスmatrixと言う。
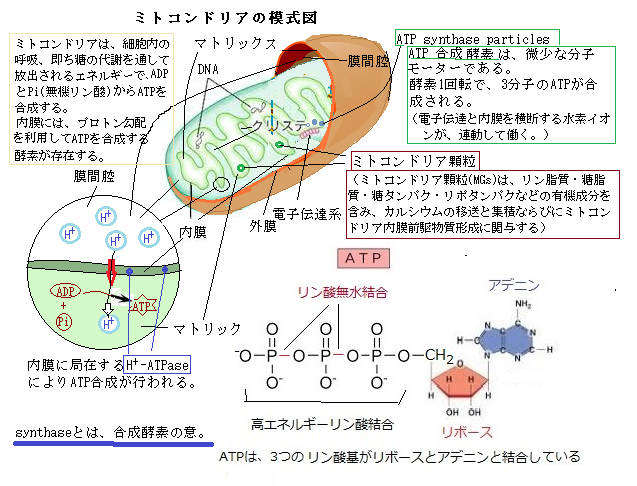 電子は、NADH-Qレダクターゼ・Q-シトクロムcレダクターゼ・シトクロムcオキシダーゼと呼ばれる3つの大きなタンパク質複合体からなる呼吸鎖を経由して、NADHからO2へエネルギー勾配を下って流れ伝達される。これらの膜貫通複合体内部での電子の流れが、ミトコンドリア内膜を横切るプロトンの汲み出しで駆動する。
電子は、NADH-Qレダクターゼ・Q-シトクロムcレダクターゼ・シトクロムcオキシダーゼと呼ばれる3つの大きなタンパク質複合体からなる呼吸鎖を経由して、NADHからO2へエネルギー勾配を下って流れ伝達される。これらの膜貫通複合体内部での電子の流れが、ミトコンドリア内膜を横切るプロトンの汲み出しで駆動する。電子の流れなは、4つのタンパク質複合体により触媒される。放出されたエルギーはプロトン勾配の生成に使われる。コハク酸-Qレダクターゼと呼ばれる4つ目の大きなタンパク質複合体は、クエン酸回路の中でFADH2を生成するコハク酸デヒドロゲナーゼを含んでいる。
NADH-Qレダクターゼ・コハク酸-Qレダクターゼ・Q-シトクロムcレダクターゼ・シトクロムcオキシダーゼは、は、それぞれ複合体と呼ばれているが、NADH-Qレダクターゼ・Q-シトクロムcレダクターゼ・シトクロムcオキシダーゼは、レスピラソームrespirasomeと呼ばれる巨大分子複合体を作っている。レスピラソームと呼ばれるミトコンドリアの電子伝達鎖複合体は、呼吸鎖複合体を空間的に連結して効率的に電子を伝達する仕組みと考えられる。細胞呼吸とエネルギー生産に際し、基質の迅速な伝達を促進し、反応中間体の放出を妨げる。
コハク酸-Qレダクターゼは、他の複合体とは対照的にプロトンの汲み出しをしない。FADH2からの電子は、Q-シトクロムcレダクターゼのところで電子伝達系に入る。
NADH2+として運ばれた水素Hは、水素イオンH+と電子e-に分かれ、その電子はミトコンドリア内膜にあるタンパク質複合体に次々と受け渡され酸化還元反応を繰り返す。この電子の流れによって生じたエネルギーにより、マトリック側にある水素イオンが内膜を通過し、内膜と外膜の間隙に能動輸送される。その結果、内膜を挟んでマトリック側と間隙側で水素イオンの濃度勾配が生じ、その濃度勾配に従ってATP合成酵素を通過する際に、ミトコンドリア膜表在性のQ-シトクロムcレダクターゼに渡された電子は、シトクロムcオキシダーゼ複合体に送られる。シトクロムcオキシダーゼは、還元型シトクロムcを酸化し、生じた電子がO2分子に渡される。1/2分子のO2がマトリックス内の2個のH+と結合すると1分子の水が作られる。実際は4電子で水2分子が生成される。
NADH + 1/2O2 + H+ ➡ H2O + NAD+
(NADH ⇔ NAD+ + H+ + 2e- ; H2O ⇔ 1/2O2 + 2H+ + 2e-)
反応全体は、発エルゴン反応である。重要なのは、この電子の流れにより放出されたエネルギーを電子伝達系の複合体のうちの3つが用いられ、ミトコンドリアマトリックスから細胞質へプロトンの汲み上げを行うことである。本質的にはエネルギーの転移であるが、結果として生じたプロトンの分布の偏りにより、pH勾配と膜を介した電位差が発生してプロトン駆動力proton-motive forceを生み出す。プロトンが酵素複合体を通ってミトコンドリアマトリックスに戻る時にATPに合成される。
ADP + Pi + H+ ⇔ ATP + H2O
このように燃料の酸化とADPのリン酸化は、ミトコンドリアン内膜を横切るプロトン勾配によって共役している。
酸化とATP合性は、膜を介したプロトンの流れによって共役している。NADHとFADH2から4つのタンパク質複合体を通って電子が流れ、酸素を水に還元する。複合体の内3つがミトコドリアのマトリックスから外側へプロトンを汲み出す。もう一つのタンパク質合成酵素であるATP合成酵素を通って、プロトンはマトリックに戻り、ATP合成を駆動する。
ミトコンドリアで起こるクエン酸回路の呼吸と呼ばれる生化学反応の目的は、高エネルギー電子を生み出すことである。
目次へ